时间:2017-08-10 00:39:54
1、选择题 如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是 
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
参考答案:D
本题解析:D项中,XZ线上任意点均为中性,是c(H+)=c(OH-),但pH=-lg c(H+),不一定是7。+)和c(OH-)的关系。
本题难度:一般
2、选择题 将0.5mol的下列物质溶于500ml水中,,含阴离子数目最多的是(?)
A.CaCO3
B.CH3COONa
C.NH3
D.Na2SO3
参考答案:D
本题解析:略
本题难度:简单
3、填空题 (8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
HSO4-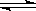 H++SO42— H++SO42— | HSO4-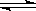 H++SO42- H++SO42- | CH3COOH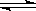 CH3COO-+H+ CH3COO-+H+ | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
参考答案:(1)H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O?(2)①④②③
(3)③②①④?(4)硫酸的一次电离抑制了HSO4-的电离
本题解析:(1)根据已知信息可知,硫酸的第二步电离存在电离平衡,所以和氢氧化钡反应的方程式为H++HSO4-+Ba2+ +2OH-=BaSO4↓+2H2O。
(2)硫酸的第二步电离的电离度是10%,所以硫酸溶液中氢离子的浓度为0.1mol/L+0.1mol/L×10%=0.11mol/L。盐酸全部电离,氢离子浓度是0.1mol./L。磷酸氢钠溶液中HSO4-的电离度是29%,所以氢离子浓度为0.1mol/L×0.29=0.029mol/L。醋酸的电离度是1.33%,所以氢离子浓度是1.33%×0.1mol/L=0.00133mol/L,所以大小顺序为①④②③。
(3)酸越弱,当pH相等时,相应物质的浓度就越大,即醋酸的浓度大于磷酸氢钠的浓度。因为硫酸是二元酸,盐酸是一元强酸,因此当pH相同时,硫酸最终提供的氢离子要多于盐酸中的氢离子,所以大小顺序为③②①④。
(4)HSO4-能电离出氢离子,而硫酸第一步完全电离,生成的氢离子,可抑制HSO4-能电离。
本题难度:一般
4、简答题 硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)?△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)?△H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是?。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为?,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示?。
②滴加过程中,溶液中微粒浓度大小关系正确的是?(填字母)。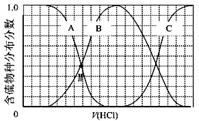 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为???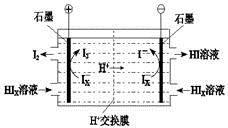 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: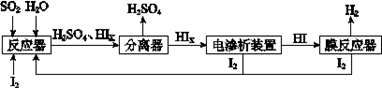
① 写出反应器中发生反应的化学方程式是?。
② 电渗析装置如右图所示,写出阳极的电极反应式?。该装置中发生的总反应的化学
参考答案:(1)xCOS(g)=XCO(g)+Sx(s)△H=0.5x(b-a)akJ/mol
(2)3NA
(3) ①HS-(或NaHS)
② c?
③ c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+)
(4)①SO2+xI2+2H2O=H2SO4+2HIx
②2Ix—-2e-=xI2 ?2HIx=(x-1)I2+2HI
本题解析:(1)①SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)?△H=akJ/mol
②2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)?△H=bkJ/mol。由盖斯定律可得,xCOS(g)=Xco(g)+Sx(s)△H=0.5x(b-a)akJ/mol;
(2)根据As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,若生成H3AsO4的物质的量为2mol时,电子转移为10mol,若生成H3AsO4的物质的量为0.6mol时,电子转移为3NA;
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量发生的反应依次为,NaOH+HCl=NaCl+H2O、Na2S+HCl=NaCl+NaHS、NaHS+HCl=H2S+NaCl。①结合图像分析,B表示HS-;②根据元素守恒知,滴加过程中,溶液中微粒浓度大小关系为c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],选c;③A表示Na2S,B表示NaHS,当滴加盐酸至M点时,表示两者含量相等,溶液中
c(Na+)=3[c(H2S)+c(HS?)+c(S2?)],则c(Na+)>c(HS-),NaHS溶液呈碱性,说明其水解大于电离,水解是微弱的,所以c(HS-)>c(S2-),硫化钠为强碱弱酸盐,其溶液呈碱性,所以c(OH-)>c(H+),则c(Na+)>c(HS-)>c(S2-)>c(OH-)> c(H+);
(4)由工艺流程图可知,SO2、I2、H2O反应生成H2SO4、HIX,反应方程式为:SO2+xI2+2H2O=H2SO4+2HIX;②由题给装置图可知,在阴极区Ix-转化为I-,在阳极区Ix-转化为I2,所以阳极区发生的反应为:2Ix--2e-=xI2,电解HIx生成I2、HI,反应方程式为:2HIx═(x-1)I2+2HI。
本题难度:一般
5、选择题 在100 mL某一元弱酸(HA)的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( ? )
A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定终点时,c(A-)=c(Na+)>c(H+)=c(OH-)
参考答案:C
本题解析:略
本题难度:简单