时间:2017-08-10 00:36:35
1、选择题 将标准状况下体积为2.24L的H2S缓慢通入100ml, 1.5mol/LNaOH溶液中(溶液体积变化忽略不计),充分反应,下列关系错误的是?(?)
A.c(Na+)+ c(H+)= c(HS-)+2 c(S2-)+ c(OH-)
B.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
C.c(Na+)>[c(HS-)+c(S2-)+c(H2S)]
D.c(HS-)+c(S2-)+c(H2S)=1.0mol/L
2、选择题 pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是(?)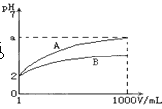
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a=5时,A是弱酸,B是强酸
D.若A、B都是弱酸,则5>a>2
3、选择题 已知:在100℃时,纯水的c(H+)为1×10—6,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为
A.1∶9
B.10∶1
C.9∶1
D.1∶10
4、选择题 25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
A.a c曲线上的任意一点都有c(H+) 91EXAM.org·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
5、选择题 水的电离平衡曲线如图所示,下列说法不正确的是? ( )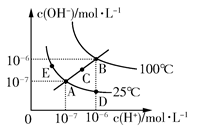
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性