时间:2017-08-10 00:36:12
1、填空题 下表中的数据表示破坏1 mol物质中的化学键需消耗的能量(即键能):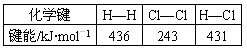
H2和Cl2反应生成HCl过程中的热效应可用下图表示,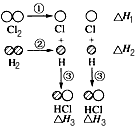
请回答下列问题:
(1)ΔH1=?___________ kJ·mol-1,该反应的热化学方程式为 _________________________________________________________________________________________
(2)据实验测定,H2和Cl2的混合气体在光照下反应生成HCl引发该反应的步骤是上图①~③中分子转化为原子的一步,你认为是第________(填序号)步,请说明原因:________________________________________________________________________。
参考答案:(1)+243;H2 (g) + Cl2 (g) = 2HCl (g)? ?ΔH1= -183 kJ·mol-1(2)①;该反应的需要的能量最低首先被破坏
本题解析:
本题难度:一般
2、填空题 (1)分析下列物体的物理性质,判断其晶体类型:
①碳化铝为黄色晶体,熔点为2200℃熔融态不导电。___________;
②五氟化钒为无色晶体,熔点为19.5℃,易溶于乙醇、氯仿、丙酮中。____________;
③溴化钾为无色晶体,熔融时或溶于水中都能导电。___________;
(2)从能量角度看,断开化学键要_________,形成化学键要___________。
(3)水的分解需要吸收热量,试从化学键变化的角度分析原因_________________________________,该反应△H________0(填<,>)。
参考答案:(1)①原子晶体;②分子晶体;③离子晶体
(2)吸收能量;放出能量
(3)水分子断开化学键变成氢原子和氧原子吸收能量大于氢原子、氧原子形成化学键变成氢气、氧气放出的能量;<
本题解析:
本题难度:一般
3、填空题 工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式: 。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题: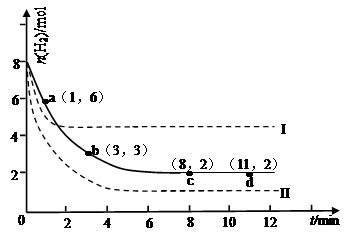
(1)a点正反应速率 (填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是 ,最小的是 。
A.0~1min
B.1~3min
C.3~8min
D.8~11min
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
参考答案:CO2(g)+3H2(g) = CH3OH(g)+H2O(g) △H= -49.5kJ·mol-1
(3分,方程式2分,△H的表示1分,化学式、状态错误0分;-、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分)
(1)大于 (2分) (2)A(1分), D (1分)
(3)
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量浓度(mol /L) 3 4 0 0
转化物质的量浓度(mol /L) 1 3 1 1
平衡物质的量浓度(mol /L) 2 1 1 1 (1分)
H2的转化率=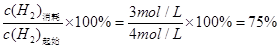 或0.75
或0.75
(2分,用分数表示扣1分,代入数值不带单位不扣分,不考虑有效数字)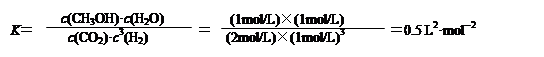 (3分)
(3分)
(其中列式1分,代入数值1分,结果1分;结果、单位错误合扣1分,代入数值不带单位不扣分,K值不带单位不扣分,不考虑有效数字)
(4)升高温度(2分) 增大压强(2分)
本题解析:已知4.4g CO2气体与H2经催化加氢生成CH3OH气体和水蒸气时放出4.95kJ的能量,则1mol二氧化碳全部反应放热49.5KJ;结合热化学方程式书写方法写出热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.5KJ/mol;
(1)根据图象可知,a到b过程中氢气的物质的量减小,说明反应向着正向移动,正反应速率大于逆反应速率,
故答案为:大于;
(2)由图1可知,0~1min内氢气的变化量为8mol-6mol=2mol; B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol; C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;D.8~11min达平衡状态,氢气的物质的量不再变化.故1~3min速率增大,8~11min速率最小,
故答案为:A;D;
(3)由图象可知,实线表示的曲线,在8分钟达到平衡状态,此时氢气的物质的量为2mol,氢气的浓度为:2/2=1mol/L氢气的浓度变化为:8/2减去1等于3mol反应前二氧化碳的浓度为:6/2=3mol/L利用化学平衡的三段式可得,
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始物质的量浓度(mol /L) 3 4 0 0
转化物质的量浓度(mol /L) 1 3 1 1
平衡物质的量浓度(mol /L) 2 1 1 1 (1分)
H2的转化率=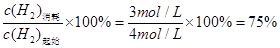 或0.75
或0.75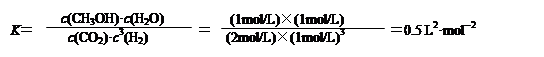
(4)对于可逆反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,正反应是体积减小的放热反应;由图1可知,曲线Ⅰ最先到达平衡,平衡时氢气的物质的量增大,故改变条件应增大反应速率且平衡向逆反应移动,可以采取的措施为:升高温度;曲线Ⅱ到达平衡的时间比原平衡短,平衡时氢气的物质的量减小,故改变条件应增大反应速率且平衡向正反应移动,可以采取的措施为:增大压强或者是增大CO2浓度,
故答案为:升高温度;增大压强.
考点:本题考查化学平衡图象、反应速率大小判断、外界条件对平衡的影响等
本题难度:一般
4、选择题 已知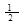 (1)H2(g)+ O2(g)===H2O(g) △H1=a kJ·mol-1
(1)H2(g)+ O2(g)===H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) △H2=b kJ·mol-1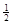 (3)H2(g)+ O2(g)===H2O(l) △H3=c kJ·mol-1
(3)H2(g)+ O2(g)===H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:由于氢气与氧气反应属于放热反应,所以△H<0,故BD错误,将(1)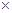 2得到(2),所以2a=b<0,故C正确。,由于H2O(g)转化为H2O(l)要放热,所以c<a<0,故A错误,答案为C。
2得到(2),所以2a=b<0,故C正确。,由于H2O(g)转化为H2O(l)要放热,所以c<a<0,故A错误,答案为C。
考点:热力学方程
点评:该题是基础性试题的考查,属于高考中的常见考点之一,解答的关键是要弄清楚△H的符号表示关系,即吸热是大于0,放热是小于0。
本题难度:简单
5、选择题 下列反应一定能自发进行的是
A.放热反应
B.熵增加的反应
C.熵增加的吸热反应
D.熵增加的放热反应
参考答案:D
本题解析:只要△G<0,反应就是自发进行的。又因为△G=△H-T·△S,所以选项D一定是自发进行的,答案选D。
本题难度:困难