时间:2017-08-10 00:35:50
1、选择题 为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是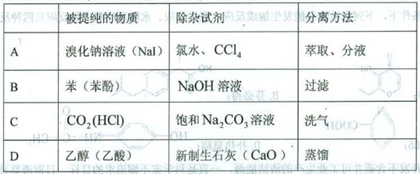
参考答案:D
本题解析:A、氯水具有氧化性,能将溴化钠中的溴离子和碘化钠中的碘离子氧化,不会得到溴化钠,故A错误。B、氢氧化钠与苯酚反应生成苯酚钠,而由于苯不溶于水,应该使用分液的方法分离,错误。C、碳酸钠溶液同样会吸收二氧化碳,所以应该换成饱和碳酸氢钠溶液,错误。D、乙酸与生石灰反应生成乙酸钙,为离子化合物。与乙醇相比,乙醇的沸点低得多,所以D正确。
点评:本题考查物质的分离提纯,题目难度不大,注意根据物质的性质差异性选择物理或化学方法进行分离。
本题难度:一般
2、选择题 乙酸乙酯的制备实验中,得到乙酸乙酯、乙酸和乙醇的混合物。下列有关分离、提纯的方法可行的是(?)
A.在混合物中继续加入浓硫酸、加热可得到纯净的乙酸乙酯
B.先加入氢氧化钠浓溶液,再进行蒸馏可得到乙酸乙酯
C.先加入饱和碳酸钠溶液,再进行分液可得到乙酸乙酯
D.分离出乙酸乙酯后的混合液,可继续用分液漏斗分离乙酸和乙醇
参考答案:C
本题解析:A项:不可行也不可取
B项:酯在强碱溶液将水解,排除
C项:正确;碳酸钠溶液可以吸收乙酸,溶解乙醇并降低乙酸乙酯的溶解度,分层后进行分液即可得到上层的酯,答案为C
D项:乙酸与乙醇互溶,不可能通过分液分离,排除
答案为C
本题难度:简单
3、填空题 (6分)为除去粗盐中的CaCl2、MgCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)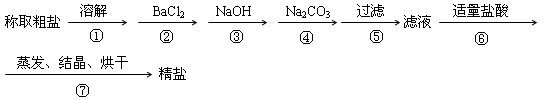
(1)判断BaCl2已过量的方法是?
(2)在第⑥步中,写出所有反应的化学方程式?
参考答案:(6分)(1)取少量上层清液加入到试管中,向其中滴加稀硫酸产生白色沉淀,证明氯化钡 过量(或取少量上层清液加入到试管中,向其中滴加氯化钡溶液不产生沉淀,证明氯化钡过量)(2分)
(2)HCl+NaOH====NaCl+H2O?(2分)2HCl+Na2CO3="==2" NaCl+ H2O+CO2↑(2分)
本题解析:(1)判断BaCl2已过量的方法是继续加入氯化钡溶液合伙加入稀硫酸,即取少量上层清液加入到试管中,向其中滴加稀硫酸产生白色沉淀,证明氯化钡过量(或取少量上层清液加入到试管中,向其中滴加氯化钡溶液不产生沉淀,证明氯化钡过量)。
(2)由于加入的氢氧化钠和碳酸钠都是过量的,所以反应的方程式分别是HCl+NaOH====NaCl+H2O、2HCl+Na2CO3="==2" NaCl+ H2O+CO2↑。
本题难度:一般
4、选择题 下列说法正确的是
A.摩尔是表示物质粒子数量的单位
B.物质的量可理解为物质的质量
C.摩尔是表示物质的量的单位
D.摩尔是七个基本物理量之一
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列除杂质的操作方法正确的是( )
A.CO2中有少量的SO2--通入酸性高锰酸钾溶液洗气后再干燥
B.NaCl溶液中有少量的Na2SO4--加过量的BaCl2再过滤
C.NO2中有少量的NO--通入足量的氧气
D.除去NaHCO3固体中少量的Na2CO3--加热
参考答案:A.SO2具有还原性,可与高锰酸钾发生氧化还原反应,生成溶于水的硫酸,干燥后可得到纯净的二氧化碳气体,故A正确;
B.加过量的BaCl2引入新的杂质,不符合除杂原则应加入适量的氯化钡,或用结晶法分离,故B错误;
C.通入足量的氧气引入新的杂质,应加入适量氧气,故C错误;
D.除杂时不能引起被提纯物质的变化,因NaHCO3不稳定,加热分解而变质,故D错误.
故选A.
本题解析:
本题难度:一般