时间:2017-08-10 00:34:23
1、简答题 某食用白醋是由醋酸与纯水配制而成,用0.1000mol/LNaOH溶液准确测定其中醋酸的物质的量浓度.以下为某同学列出的实验步骤(未排序),请回答下列问题.
A.分别向碱式滴定管、酸式滴定管注入NaOH标准溶液和待测醋酸至0刻度以上2~3cm
B.调节滴定管液面至0或0刻度以下,记下读数
C.用NaOH标准溶液滴定至终点,记下滴定管液面的刻度
D.用标准溶液清洗碱式滴定管2~3次;待测醋酸清洗酸式滴定管2~3次
E.用待测醋酸清洗锥形瓶2~3次
F.排气泡使滴定管尖嘴充满溶液,把滴定管固定好
G.滴定管检漏,用水清洗所有仪器,备用
H.通过酸式滴定管向锥形瓶注入20.00mL待测醋酸,并加入2-3滴指示剂
(1)用离子方程式表示该实验的原理______.
(2)从上述实验步骤中选出正确的并按操作先后排序.你的实验顺序为:(用字母表示)______.
(3)实验室常用的酸碱指示剂有甲基橙、石蕊和酚酞,你选择的指示剂是______,理由是______;滴定终点的现象是______.
(4)某同学实验后得到的数据如下:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 V(NaOH)/mL(初读数) 0.00 0.20 0.00 0.10 0.05 V(NaOH)/mL(终读数) 15.75 15.20 14.98 15.12 15.05 |
参考答案:(1)氢氧化钠与醋酸生成醋酸钠和水,用离子方程式表示该实验的原理为:CH3COOH+OH-=CH3COO-+H2O,故答案为:CH3COOH+OH-=CH3COO-+H2O;
(2)滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数,
故答案为:G→D→A→F→B→H→C;
(3)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
故答案为:酚酞;两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色;
(4)五次实验消耗氢氧化钠溶液体积分别为15.75mL、15.00mL、14.98mL、15.02mL、15.00mL,其中15.75mL误差太大,应舍弃,所以氢氧化钠溶液体积平均为15.00mL,氢氧化钠溶液浓度为0.1mol/L,醋酸体积为20.00mL,由C(NaOH)V(NaOH)=C(CH3COOH)V(CH3COOH)得醋酸物质的量浓度为0.07500mol/L,
故答案为:0.07500;
(5)①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡,则氢氧化钠溶液体积偏小,根据c(待测)=c(标准)×V(标准)V(待测)可知醋酸浓度偏小,故答案为:偏低;
②读取标准溶液体积时,滴定前平视、滴定后仰视,则氢氧化钠溶液体积偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知醋酸浓度偏高,故答案为:偏高.
本题解析:
本题难度:一般
2、选择题 下列实验操作会引起测量结果偏高的是
[? ]
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡。
②配制烧碱溶液时,将称量后的NaOH同体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线。
③中和滴定时,锥形瓶内有少量水。
④用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,酸式滴定管用蒸馏水洗涤后,未用标准液润洗。
⑤用已知液滴定未知液时,读取滴定管终点读数时,俯视刻度线。
A. 只有④
B. 只有②④
C. 只有②④⑤
D. 全部
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列图示与对应的叙述相符的是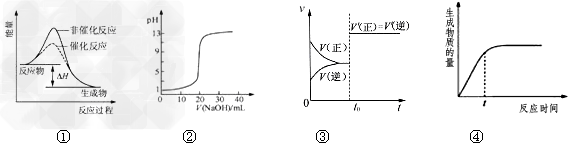
[? ]
A.图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图②表示0.1000?mol/LNaOH溶液滴定20.00mL?0.1000?mol/LHCl溶液所得到的滴定曲线
C.图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
D.图④表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
参考答案:B
本题解析:
本题难度:一般
4、实验题 用0.1000mol/LNaOH溶液滴定未知浓度的盐酸,进行以下滴定操作:
A.用蒸馏水洗净碱式滴定管,然后用标准NaOH溶液润洗,再将标准NaOH溶液装入碱式滴定管中,调整液面至零刻度线。
B.用酸式滴定管量取25.00mL盐酸于锥形瓶中,并滴加几滴酚酞指示剂。
C.在锥形瓶下垫一张白纸,滴定至终点,记下读数为20.00mL。就此实验完成下列填空:
(1)滴定时眼睛应观察______________ 。
(2)滴到终点,溶液的颜色由_______色变为_______色,且半分钟内不褪色。
(3)根据上述数据求得盐酸的物质的量浓度为 __________mol/L。
参考答案:(1)锥形瓶中溶液的颜色变化?
(2)无?; 粉红(浅红)
(3)0.08000
本题解析:
本题难度:一般
5、选择题 下列有关化学实验的叙述中,正确的是
[? ]
A.中和滴定实验中应用待测液润洗锥形瓶
B.蒸馏操作时应将温度计的水银球插入液面下
C.用重结晶的方法提纯苯甲酸时应趁热过滤
D.NaOH溶液应保存在带玻璃塞的试剂瓶中
参考答案:C
本题解析:
本题难度:简单