时间:2017-08-10 00:18:39
1、选择题 室温下,下列溶液中粒子关系关系正确的是
A.Na2CO3溶液:c(Na+)+c(H+)=c(H2CO3)+c(HCO3-)+c(OH-)+c(CO32-)
B.NaHSO3溶液:c(H+)+c(H2SO3)=c(HSO3-)+c(OH-)
C.KAl(SO4)2溶液:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
D.NH4Cl和CaCl2混合溶液:c(Cl-)>c(Ca2+)>c(NH4+)>c(H+)>c(OH-)
参考答案:C
本题解析:Na2CO3溶液中电荷守恒:c(Na+)+c(H+)= c(HCO3-)+c(OH-)+2c(CO32-),故A项错误;NaHSO3溶液质子守恒:c(H+)+c(H2SO3)=c(SO32—)+c(OH-),故B项错误;KAl(SO4)2溶液存在离子为SO42-、K+、Al3+、H+、OH-,其中Al3+水解溶液呈酸性,故大小关系为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-),C项正确;NH4Cl和CaCl2混合溶液,但不知两者的相对大小,故不能确定Ca2+、NH4+的相对大小,D项错误。
考点:溶液中离子浓度关系。
本题难度:一般
2、选择题 现有1.0 mol/L的NaOH溶液0.1L,若通入标准状况下体积为2.24L 的SO2气体,使其充分反应后,则所得溶液中各粒子浓度大小关系正确的是
A.c(Na+)+c(H+) = c(HSO3―) +c(SO32―) + c( OH―)
B.c(Na+) = c(H2SO3) + c(HSO3―) + c ( H+)
C.c(SO32―) + c( OH―) = c(H+) + c(H2SO3)
D.c(Na+)>c(HSO3―)>c( OH―)>c(H2SO3)>c(SO32―)>c(H+)
参考答案:C
本题解析:试题分析:n(SO2)=2.24L÷22.4L/mol=0.1mol, n(NaOH)=0.1L×1mol/L=0.1mol,二者反应的化学方程式为SO2+NaOH=NaHSO3,反应后为NaHSO3溶液,则
溶液存在电荷守恒,则应有c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故A不正确;根据物料守恒,则c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+)=1mol?L-1,所以B不正确;根据物料守恒和电荷守恒可知,c(SO32―) + c(OH-)=c(H+)+c(H2SO3),C正确;HSO3-的电离程度大于水解程度,溶液显酸性,所以选项D不正确,答案选C。
考点:考查离子浓度大小比较
点评:该题是高考中的常见题型,属于中等难度试题的考查。本题注意根据反应物的物质的量判断反应物,比较离子浓度大小关系时,常常用到电荷守恒、物料守恒以及质子守恒等方法,做题时注意体会和总结。
本题难度:简单
3、填空题 (7分)请根据所学化学知识回答下列问题:
(1)在浓度均为0.1 mol/L ①CH3COONH4、②NH4HSO4、③NH3·H2O、④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)。
(2)氯化铝溶液蒸干,灼烧得到的固体物质是_________,用化学方程式说明其原因:
(3)某温度时蒸馏水的pH=6。将2.3 g金属钠放入该蒸馏水中,充分反应后再加该蒸馏水稀释到1 L,恢复到原温度时所得溶液的pH= 。
参考答案:(1)④>②>①>③(2分);
(2)Al2O3(1分);Al3++3H2O Al(OH)3+3H+,2Al(OH)3
Al(OH)3+3H+,2Al(OH)3 Al2O3+H2O(2分);
Al2O3+H2O(2分);
(3)11(2分)
本题解析:(1)一水合氨为弱电解质,溶液中c(NH4+)最小;相同浓度的铵盐溶液中,NH4+系数越大,c(NH4+)越大,相同系数、相同浓度的铵盐溶液中,NH4+水解程度越大,则溶液中c(NH4+)越小,H+抑制铵根离子水解、CH3COO-促进NH4+水解,所以相同浓度的这几种溶液中c(NH4+)由大到小的顺序为④>②>①>③,故答案为:④>②>①>③。
(2)氯化铝能水解生成氢氧化铝,氯化氢具有挥发性,加热促进氯化氢挥发,从而促进氯化铝水解,则蒸干溶液时得到Al(OH)3固体,灼烧Al(OH)3固体时分解得到Al2O3,反应方程式为,故答案为:Al2O3;Al3++3H2O?Al(OH)3+3 H+、2Al(OH)3 Al2O3+H2O。
Al2O3+H2O。
(3)某温度时蒸馏水的pH=6,则水的离子积常数K=10-12,2.3gNa的物质的量为0.1mol,根据原子守恒得n(NaOH)=n(Na)=0.1mol,则C(NaOH)=0.1mol÷1L=0.1mol/L,溶液中c(H+)=10-11 mol/L,则pH为11。
考点:本题考查离子浓度大小比较、盐类水解、pH的计算。
本题难度:一般
4、选择题 下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC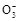 )+c(H+)>c(C
)+c(H+)>c(C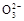 )
)
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S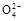 )>c(N
)>c(N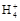 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC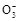 )>c(H+)
)>c(H+)
D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
参考答案:D
本题解析:根据质子守恒有:c(OH-)=c(HC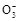 )+c(H+)+2c(H2CO3),A错;B中c(N
)+c(H+)+2c(H2CO3),A错;B中c(N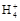 ) >c(S
) >c(S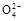 ),B错;C中NaHCO3溶液显碱性,以水解为主,但水解是微弱的,所以c(HC
),B错;C中NaHCO3溶液显碱性,以水解为主,但水解是微弱的,所以c(HC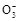 )>c(OH-),C错;D项符合物料守恒,正确。
)>c(OH-),C错;D项符合物料守恒,正确。
本题难度:一般
5、填空题 常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(3)物质的量浓度相同的①氨水②氯化铵③碳酸氢铵④硫酸氢铵⑤硫酸铵
在上述五种溶液中,铵根离子物质的量浓度由大到小的顺序是
(4)已知拆开1molH—H键,1molN—H键,1molN≡N键分别需要的能量是436kJ、39l kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
参考答案:(1)①②⑤⑥③④ (2)Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
(3)⑤>④>②>③>① (4)N2(g)+3H2(g) 2NH3(g)
2NH3(g) 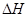 =-92.0kJ/mol
=-92.0kJ/mol
本题解析:(1)盐酸是一元强酸,醋酸是一元弱酸,醋酸钠是弱酸强碱盐,氢氧化钠是一元强碱。氯化铁是强酸弱碱盐,氯化钠是强酸强碱盐,所以在浓度相等的条件下,pH由小到大排列顺序为①②⑤⑥③④。
(2)氯化铁溶于水,铁离子水解生成氢氧化铁和盐酸,所以加入盐酸的目的是抑制铁离子的水解,方程式是Fe3++3H2O Fe(OH)3+3H+。
Fe(OH)3+3H+。
(3)在溶液中NH4+水解,而硫酸氢铵能电离出氢离子,抑制NH4+水解。HCO3-水解,显碱性,促进NH4+水解,所以五种溶液中,铵根离子物质的量浓度由大到小的顺序是⑤>④>②>③>①。
(4)反应热是断键吸收的能量和形成化学键所放出的能量的差值,则该反应的反应热△H=3×436kJ/mol+946kJ/mol-2×3×391kJ/mol=-92.0kJ/mol,所以反应的热化学方程式是N2(g)+3H2(g) 2NH3(g)
2NH3(g) 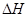 =-92.0kJ/mol。
=-92.0kJ/mol。
考点:考查pH的判断、盐类水解的应用、溶液中离子浓度比较以及反应热的计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,差值对学生灵活运用基础知识解决实际问题的能量的培养。旨在提高学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:困难