时间:2017-08-10 00:12:25
1、选择题 下列说法正确的是
[? ]
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤
B.②④⑥
C.②③④
D.①③⑥
2、选择题 下列各组互为等电子体的是
A.N2O和CO2
B.O3和NO2
C.CH4和NH3
D.OH-和NH2-
3、选择题 下列物质中属于离子化合物的是( )
A.苛性钾
B.碘化氢
C.硫酸
D.醋酸
4、填空题 (8分)已知A、B、C三种元素均为第二周期非金属元素,其原子序数依次增大,且它们之间可以形成分子式为AC、BC、AC2和BC2的四种常见化合物。A、B、C可分别与氢原子形成电子总数相等的分子。
请回答下列问题:
(1)写出A、B、C三种元素的元素符号:A________,B________,C________。
(2)AC2的电子式为____________________________________________________。
(3)氢原子可以与A、B、C分别形成两组电子总数相等的分子,其电子总数分别为________和________。
(4)由1个A原子、2个B原子、1个C原子与4个氢原子构成的分子中,每个原子最外层均达到稳定结构,该分子的结构简式为________。
5、选择题 下列化学用语或模型表示正确的是
[? ]
A.HCl的电子式 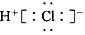
B.CO2的分子比例模型 
C.NH4I的电子式 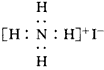
D.Cl-的结构示意图 