时间:2017-08-09 23:50:52
1、填空题 (12分)
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案: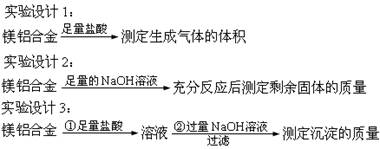
回答下列问题:
(1)上述方案中,能测出Mg的质量分数的方案是?(填写代号,下同)
A.实验设计1? B.实验设计2? C.实验设计3? D.都可以
(2)上述方案中的化学反应体现了Mg、Al的性质是??
A.氧化性? B.还原性? C.酸性? D.碱性
(3)某同学设计了右图装置。该装置适合的实验设计是?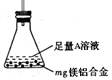

用该装置测定镁铝合金中镁的质量分数,所需的实验操作是
?。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.称量反应前后,装置和药品的总质量
(4)若按实验设计3进行实验。将m g镁铝合金,溶于过量盐酸中,再加入过量的NaOH溶液,可得到白色沉淀,该沉淀物质是?(填化学式);将此沉淀洗净、干燥后,称得质量为w g。求合金中镁的质量分数?;
参考答案:(1)D(2分) (2)B (2分)?(3) B (2分)? B (2分)
(4)Mg(OH)2 (2分)? 12w/29m(2分)
本题解析:(1)设计(1)根据镁铝合金质量及氢气的体积可计算出结果,设计(2)铝能溶于强碱而镁不溶可知剩余的是镁,设计(3)利用Al(OH)3能溶于强碱而Mg(OH)2不溶于强碱可求解;(2)金属和酸反应或和碱反应都表现了还原性;(3)设计1需要气体收集装置,设计3第一步反应完还需要继续加NaOH溶液,所以,此装置只适用于设计2,因镁不溶于NaOH溶液,所以剩余固体即为镁;(4)因Mg(OH)2不溶于NaOH溶液Al (OH)3能溶于NaOH溶液,可知剩余的是Mg(OH)2,根据镁的物质的量等于氢氧化镁的物质的量,质量等于物质的量乘以摩尔质量这一 计算式可求出镁的质量,再用镁的质量除以m克乘以100%,即可求出镁的质量分数。
本题难度:简单
2、计算题 有镁铝合金10.2 g,将它溶于500 mL 4 mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol·L-1氢氧化钠溶液的体积为多少?
参考答案:1000 mL
本题解析:此题考查镁、铝单质及其化合物的化学性质。题目中涉及四个化学反应,若是用化学方程式来列式计算,十分烦琐,而且计算量大。如果分析题意,不难发现当沉淀达到最大值的时候,即镁、铝元素分别与氢氧根离子完全结合生成沉淀,运用守恒定律,溶液中的阳离子只能为钠离子,阴离子必为氯离子,且二者的物质的量相等,所以n(NaOH)="0.5" L×4 mol·L-1="2" mol,V(NaOH)=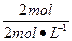 ="1" L="1" 000 mL。
="1" L="1" 000 mL。
本题难度:简单
3、选择题 将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.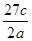
B.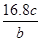
C.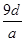
D.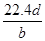
参考答案:C
本题解析:氢气的物质的量是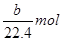 ,转移电子的物质的量是
,转移电子的物质的量是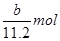 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为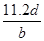 ;铝的物质的量是
;铝的物质的量是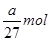 ,转移电子的物质的量是
,转移电子的物质的量是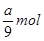 ,所以阿伏加德罗常数(NA)可表示为
,所以阿伏加德罗常数(NA)可表示为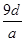 ,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
,C正确;由于溶液中溶质既有氢氧化钠,又有偏铝酸钠,不能用c表示,所以答案选C。
点评:该题的关键是明确反应的原理,以及微粒个数与阿伏加德罗常数的关系,如何结合题意灵活运用即可,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力。
本题难度:一般
4、选择题 下列叙述正确的是( )
A.合金的性质等于各成分金属的性质之和
B.单质铝既能溶于盐酸,又能溶于NaOH溶液
C.镁着火可以用CO2灭火器来灭火
D.最外层只有一个电子的元素一定是金属元素
参考答案:B
本题解析:
本题难度:简单
5、填空题 用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为____________;Al与NaOH溶液反应的离子方程式为____________。
(2)30Si的原子的中子数为________________________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是____________________________________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是____________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为____________。
参考答案:(1) ? 2Al+2OH-+2H2O=
? 2Al+2OH-+2H2O=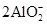 +3H2↑
+3H2↑
(2)16
(3)HCl
(4)CO2
(5)25%
本题解析:(3)根据Y所在族各元素的氢化物的水溶液均显酸性,可推知Y为F,回答沸点时要考虑到HF中含有氢键。
(5)在熔渣中加入盐酸,发生的反应为:Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,11.0 g为SiO2的质量。
在滤液中加入过量NaOH溶液,发生的反应为:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,所得21.4 g固体为Fe(OH)3,根据关系式:
2Fe(OH)3~Fe2O3
214? 160
21.4 g? m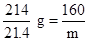 ? m="16" g
? m="16" g
由此可知:
Al2O3的质量="36.0" g-11.0 g-16.0 g="9.0" g,
故Al2O3的质量分数=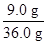 ×100%=25%。
×100%=25%。
本题难度:一般