时间:2017-08-09 23:49:01
1、选择题 0.02mol·L—1的HCN溶液与0.02mol·L—1的NaCN溶液等体积混合,已知混合溶液中C(CN-)<C(Na+),则下列关系中,正确的是:
A.C(Na+)>C(CN-)>C( H+)>C(OH-)
B.C(HCN)+C (CN-)=0.04mol·L-1
C.C(CN-)>C(HCN)
D.C(Na+)+C(H+)= C(CN-)+C(OH-)
参考答案:D
本题解析:设以100L等体积混合,即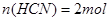 ;
;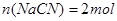 溶合后,根据电荷守恒得
溶合后,根据电荷守恒得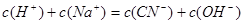 ,因C(CN-)<C(Na+),得
,因C(CN-)<C(Na+),得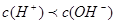 ,即混合溶液显碱性,以CN—的水解为主;所以
,即混合溶液显碱性,以CN—的水解为主;所以
A错,正确为C(Na+)>C(CN-)>C(OH-)>C( H+);B错,C(HCN)+C (CN-)=0.02mol·L-1;C错,正确关系为C(HCN)>C(CN-);D正确,电荷守恒;
本题难度:困难
2、选择题 根据右表,以下错误的是
| 酸 | HF | H3PO4 |
| 电离常数 | Ki =" 3.6×10" - 4 | Ki1=" 7.5×10" -3 Ki2=" 6.2×10" -8 Ki3=" 2.2×10" -13 |
参考答案:C
本题解析:根据表格提供的数据可知HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,所以根据强酸制取弱酸的性质可知,NaF和H3PO4反应的产物只有HF、NaH2PO4,正确;B.Na3PO4 、Na2HPO4 、NaF、NaH2PO4都是强碱弱酸盐。弱酸根离子发生水解反应而消耗水电离产生的H+,是溶液显碱性。酸的电离平衡常数越小,相应的酸根离子水解程度就越大,溶液的碱性就越强,pH就越大。由于HF的电离平衡常数小于H3PO4的一级电离平衡常数,大于H3PO4的二级电离平衡常数,H3PO4的二级电离平衡常数大于H3PO4的三级电离平衡常数,所以等浓度的这几种盐溶液的pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4,正确;C.H3PO4是三元弱酸,电离分步进行。主要发生第一不电离。H3PO4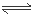 H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=
H++H2PO4-。而且第一步的电离会对第二、第三步的电离平衡起抑制作用。假设发生该步电离产生的H+的浓度是x,则K=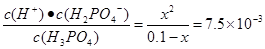 。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
。解得x=2.74×10-2mol/L<0.1mol/L,错误;D.在两种溶液中微粒都存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(F-);c(Na+)+c(H+)=c(OH-)+c(H2PO4-);每种溶液中含有的离子都是Na+和H+浓度的2倍。在NaF和NaH2PO4溶液中都存在阴离子的水解作用。两种盐的浓度相等,所以c(Na+)相等。根据电离平衡常数可知水解程度NaF> NaH2PO4,所以溶液中的c(OH-):NaF> NaH2PO4,则根据水的离子积常数可知溶液中溶液中c(H+):NaH2PO4> NaF,所以在25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者,正确。
考点:考查电离平衡常数在物质发生反应的产物的确定及溶液中微粒浓度大小比较中的应用的知识。
本题难度:一般
3、选择题 结构简式为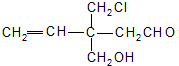
的有机物,不能发生的反应是( )
A.消去反应
B.加成反应
C.酯化反应
D.银镜反应
参考答案:A
本题解析:
本题难度:简单
4、选择题 12.下列盐溶液蒸干后并灼烧,能得到原溶质的是
A.Al2(SO4)3溶液
B.MgCl2溶液
C.FeSO4溶液
D.NaClO溶液
参考答案:A
本题解析:加热时Al3+虽然水解,但硫酸难挥发,最后固体仍为Al2(SO4)3;镁离子会发生水解反应,生成氢氧化镁,而加热可以促进水解,所以最终主要生成的是氢氧化镁,再灼烧就分解成为氧化镁;还原性盐在蒸干时会被O2氧化FeSO4(aq) Fe2(SO4)3(aq); 蒸干NaClO溶液时,既要考虑ClO- 水解,又要考虑HClO分解,所以蒸干NaClO溶液所得固体为NaCl。
Fe2(SO4)3(aq); 蒸干NaClO溶液时,既要考虑ClO- 水解,又要考虑HClO分解,所以蒸干NaClO溶液所得固体为NaCl。
考点:盐类的水解
点评:盐溶液蒸干、灼烧时所得产物的判断:
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得到原物质,如CuSO4(aq) CuSO4(s)。盐溶液水解生成易挥发性酸时,蒸干、灼烧后一般得对应的氧化物,如AlCl3(aq)
CuSO4(s)。盐溶液水解生成易挥发性酸时,蒸干、灼烧后一般得对应的氧化物,如AlCl3(aq)  Al(OH)3
Al(OH)3
本题难度:一般
5、填空题 (本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时
 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2) 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
参考答案:(共13分)29.B(1分) ;30.< (2分) A、C (2分) ;31.C、D (2分)
32.增大、不变、减小(各1分)
33.NH4++H2O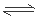 NH3·H2O + H+ (1分) 1.8×10-5% 或1.8×10-7 (2分)
NH3·H2O + H+ (1分) 1.8×10-5% 或1.8×10-7 (2分)
本题解析:29.氨气极容易溶于水,为了使氨气被充分吸收,同时又防止倒吸现象的发生,通常在导气管的末端安装一个倒扣的漏斗或一个干燥管,当氨气溶解是导气管内气体的压强减小时,水进入漏斗或干燥管,因为它们的容积较大,当较大量的水进入该装置时,烧杯内的水面下降,漏斗过干燥管内的水又流回到烧杯内,从而防止了倒吸的发生;也可以将导气管伸入到氨气不能溶解、密度比水大的有机物若CCl4中,气体从导气管内逸出,在上升的过程中遇水,发生反应、溶解,同时也防止了倒吸的发生,而B中导气管直接伸入水中会引起倒吸现象的发生,故选项是B。
30.在反应开始时,c(N2)=0.01mol/L,c(H2)=0.01mol/L,c(NH3)=0.02mol/L,Qc= >K=
>K=  ,说明平衡逆向移动,
,说明平衡逆向移动, <
< ; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
; A.压缩容器体积物质的浓度增大,体系的压强增大,正反应速率加快,由于正反应是气体体积减小的反应,所以增大压强,平衡正向移动,正确;B.适当升高温度单位体积内活化分子数增加,化学反应速率加快,由于该反应的正反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,错误;C.通入适量氮气,即增大了反应物的浓度正反应速率加快,增大反应物浓度,平衡向正反应方向移动,正确;D.加适量催化剂,正反应和逆反应的速率都加快,由于催化剂对正反应和逆反应速率影响相同,所以加入催化剂,平衡不发生移动,错误;选项A、C。
31. A.根据方程式中氢气与氨气的系数关系可知,在任何时刻都存在2υ (H2) 3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
3υ(NH3),因此不能作为判断平衡的标志,错误;B.由于反应是在体积恒定不变的容器内进行的反应,反应前后气体物质的质量不变,所以在任何时刻都存在混合气体的密度不变,故不能作为判断平衡的标志,错误;C.该反应的正反应是气体体积减小的反应,若反应为达到平衡状态,则气体的物质的量就会发生变化,而气体的质量也不变,则混合气体的平均相对分子质量就必然发生改变,现在气体的相对分子质量不变,说明气体的物质的量不变,反应处于平衡状态,正确;D.单位时间内生成n mol N2,就会同时消耗2nmol的NH3,此时还同时生成2n mol NH3,则氨气的物质的量不变,反应处于平衡状态,正确。
32.氨气溶于水得到氨水,在氨水中存在电离平衡:NH3 · H2O NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
NH4++OH-,在所得溶液在加水稀释的过程中,由于离子浓度减小的倍数大于电解质分子极性的倍数,所以电离平衡正向移动,即NH3 · H2O的电离程度增大,而电离平衡常数至于温度有关,温度不变,则电离平衡常数就不变,加水对溶液中的离子起稀释作用,是离子浓度减小,平衡正向移动是离子浓度又增大,但是平衡移动的趋势是微弱的,所以总的来说,溶液中c(OH-)浓度减小,所以溶液的pH值减小;
33.某(NH4)2SO4水溶液的pH=5,是因为在NH4+在溶液发生水解反应NH4++ H2O  NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH="5," c(H+)=10-5mol/L,由于水的浓度是c(H2O)="(1000g÷18g/mol)" ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
NH3 · H2O +H+,消耗了水电离产生的OH-,破坏了水的电离平衡,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。溶液的pH="5," c(H+)=10-5mol/L,由于水的浓度是c(H2O)="(1000g÷18g/mol)" ÷1L=(1000/18)mol/L,则该稀溶液中水的电离度约为(10-5mol/L÷(18/1000)mol/L)×100%=1.8×10-5% 。
考点:考查防止倒吸的装置、化学平衡常数的计算与反应进行的方向的判断、影响化学反应速率和平衡移动的因素、平衡状态的判断、溶液稀释对弱电解质电离平衡的影响、盐的水解及水电离度的计算。
本题难度:一般