时间:2017-08-09 23:49:01
1、选择题 25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
参考答案:CD
本题解析:
A、C点时,醋酸的量相对于氢氧化钠过量,溶液的组成为醋酸和醋酸钠的混合物,溶液显酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B、在D点时,反应后醋酸剩余,溶液的组成为等浓度的醋酸和醋酸钠的混合物,根据物料守恒,此时:c(CH3COO-)+c(CH3COOH)=2c(Na+),故B正确;
C、在AB区间内,溶液显碱性,c(OH-)>c(H+),当氢氧化钠溶液和醋酸恰好反应是时,显碱性,此时生成的溶液可能为醋酸钠,c(OH-)<c(CH3COO-);当氢氧化钠溶液和醋酸反应后剩余氢氧化钠溶液,溶液仍然显碱性,此时若剩余的氢氧化钠量很大,则c(OH-)>c(CH3COO-),也有可能剩余的氢氧化钠和醋酸钠中醋酸根水解之后剩余的醋酸根的浓度相等,故C不正确;
D、若a=12.5,醋酸和氢氧化钠的物质的量之比为1:1,反应后溶液的组成为醋酸钠,CH3COONa为强碱弱酸盐,溶液显碱性,pH>7,介于AB之间,故D不正确。
考点:考查弱电解质、盐类水解以及酸碱滴定曲线的分析
点评:本题考查了弱电解质、盐类水解以及酸碱滴定曲线的分析,难度较大。本题解题的关键是明确酸碱反应时二者的比例关系,以及醋酸量的多少对溶液酸碱性的影响。
本题难度:困难
2、简答题 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向.
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是______.
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定.反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
主要的生产流程如下: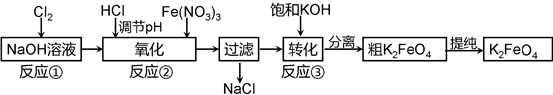
(2)①写出反应①的离子方程式______
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)______Ksp(Na2FeO4)(填“>”或“<”或“=”).
(3)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O?4Fe(OH)3↓+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是______.
(4)FeO42-在水溶液中的存在形态图如下图所示.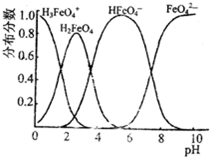
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是______.
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,______转化为______(填化学式).
参考答案:(1)该原电池中,锌易失电子发生氧化反应而作负极,故答案为:Zn;
(2)①氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)高铁酸钠具有强氧化性,所以能杀菌消毒,氢氧化铁胶体具有吸附性,所以能净水,故答案为:杀菌消毒、净水;
(4)①根据图象知,随着溶液酸性的增强,HFeO4-的分布分数先增大后减小,故答案为:先变大,后变小;
②根据图象知,随着溶液酸性的之间增强,FeO42-的分布分数逐渐增大,HFeO4-的分布分数逐渐减小,所以HFeO4-转化为FeO42-,故答案为:HFeO4-转化为FeO42-.
本题解析:
本题难度:一般
3、选择题 下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO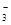 、AlO
、AlO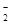 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
参考答案:D
本题解析:A、碳酸氢钠溶液中存在电离碳酸氢根离子,与偏铝酸根离子发生反应生成碳酸根离子和氢氧化铝沉淀,不可能大量存在,错误;B、若HA为强酸,则C(Na+) =C(A-);若HA为弱酸,则酸的浓度大于氢氧化钠的浓度,则等体积混合,酸过量,所得溶液为HA与NaA的混合液,溶液呈酸性,所以C(Na+) <C(A-),错误;C、醋酸加水稀释,醋酸的电离平衡正向移动,但醋酸根离子、氢离子浓度仍减小,但温度不变,水的离子积常数不变,则氢氧根离子浓度增大,错误;D、t℃时,水的离子积常数为Kw= c(OH-)×c(H+)=[c(OH-)]2,则c(OH-)=c(H+),所以溶液呈中性,正确,答案选D。
考点:考查离子大量共存的判断,酸碱混合的判断,溶液稀释离子浓度变化的判断,水离子积常数的应用
本题难度:困难
4、选择题 常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
参考答案:B
本题解析:A、碳酸氢铵溶液中,N元素与C元素符合1:1的关系,所以根据元素守恒有c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),正确;B、根据图像可知,加入氢氧化钠后溶液的碱性增强,氢氧根离子先与铵根离子反应,使铵根离子浓度逐渐减小,而碳酸氢根离子稍增大后又逐渐减小,错误;C、因为0.1mol/L的NH4HCO3溶液,pH=7.8,溶液呈碱性,说明碳酸氢根离子的水解程度大于铵根离子的水程度,根据越弱越水解,所以常温下Kb(NH3·H2O)>Ka1(H2CO3),正确;D、根据图像中pH=9时曲线的高低判断,此时溶液中粒子的浓度关系是c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),正确,答案选B。
考点:考查离子浓度大小的比较,盐水解规律的应用
本题难度:困难
5、选择题 关于常温下0.1 mol·L-1醋酸钠溶液,下列说法正确的是
A.水电离出来的c(OH-)=1.0×10-13 mol·L-1
B.该溶液的pH<13
C.溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.加入等浓度等体积的盐酸,溶液中:c(CH3COOH)+ c(CH3COO-)= c(Cl-)+ c(Na+)
参考答案:BC
本题解析:A、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解促进水的电离,水电离出来的c(OH-)远大于1.0×10-13 mol·L-1,错误;B、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解呈碱性,但醋酸根的水解微弱,该溶液的pH<13,正确;C、醋酸钠为强碱弱酸盐,醋酸钠溶液醋酸根水解呈碱性,溶液中离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),正确;D、加入等浓度等体积的盐酸,所得溶液为等浓度的醋酸和氯化钠的混合液,溶液中:2c(CH3COOH)+ 2c(CH3COO-)= c(Cl-)+ c(Na+),错误。
考点:考查盐类的水解。
本题难度:一般