时间:2017-08-09 23:45:19
1、选择题 下列说法正确的是:
A.有机物CH2=CH-CH3中其碳原子杂化类型有sp3和sp2,其中有两个π键,7个σ键
B.分子CO和N2的原子总数相同,价电子总数相等,故性质相似
C.Na+的电子排布式为1s22s22p63s1
D.NO2分子的结构VSEPR模型是直线形
参考答案:B
本题解析:A:CH2=CH-CH3中有8个σ键,1个π键
C:Na+的电子排布式为1s22s22p6
D:NO2分子中心原子上的孤对电子对数为0.5,以1来对待,分子的价层电子对数为3,所以其VSEPR模型是平面三角形,而分子的立体构型为V型。
本题难度:一般
2、填空题 (14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
参考答案:
(1)第三周期,第ⅠA族 2,1s22s22p63s23p2
(2)<,>,<,<,
(3)4CuCl(s)+O2(g)=2CuCl2(2)+2CuO(s) △H=-177.6kJ/mol
(4)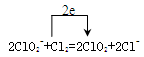
本题解析:(1)S的最外层有6个电子,为3s23p4,3p能级三个轨道、四个电子,依据泡利原理和洪特规则,先每个轨道排1个,方向相同,排满后再排,方向相反,故有两个孤对电子;硅,核电核数为14,根据构造原理可以排出。
(2)第一电离能同周期从左往右逐渐增大趋势,但有几个反常,故有Si<S;具有相同的电子层结构,核电荷越多半径越小,故有O2-<Na+;一般熔沸点原子晶体大于离子晶体;同周期从左到右非金属性逐渐增强,非金属性越强其最高价氧化物对应水化物的酸性越强。
(3)该反应为氧化还原反应,Cu从+1到+2价,O2做氧化剂,从0价到-2价。
(4)氯气做氧化剂从0价到-1价,亚氯酸根从+3到+4价。
考点:物质结构、元素及化合物性质、氧化还原反应、热化学反应方程式等
本题难度:一般
3、选择题 关于能量转化的叙述正确的是(?)
A.化学能只可以转化为热能和电能
B.原电池是化学能转化为电能的唯一途径
C.化学能转化成热能的途径只有燃烧
D.太阳能既可以转化为化学能,又可以转化成其他形式的能量
参考答案:D
本题解析:能量可以相互转化,能量间的转化形式是多种多样的。
本题难度:简单
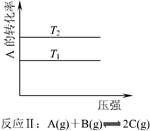
4、选择题 根据下图判断,下列说法正确的是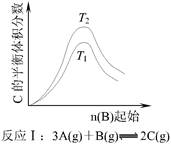 ?
?
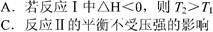 ?
?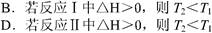
参考答案:C
本题解析:A选项反应Ⅰ中,正反应是放热反应,升高温度,平衡向逆反应方向移动,C的平衡体积分数减小。故T1﹥T2?
B选项反应Ⅰ中,正反应是吸热反应,升高温度,平衡向正反应方向移动,C的平衡体积分数增大。故T2﹥T1?
D选项反应Ⅱ中,正反应是吸热反应,升高温度,平衡向正反应方向移动,A的转化率增大。故T2﹥T1
本题难度:简单
5、填空题 (13分)(1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则: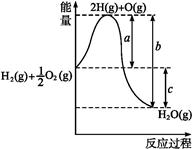
①a、b、c分别代表什么意义?
a
b
c
②该反应是 反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 ,
。(请写两条)
(3)已知:H2(g)+1/2O2(g) H2O(l) ΔH="-285.8" kJ·mol-1
H2O(l) ΔH="-285.8" kJ·mol-1
H2(g) H2(l) ΔH="-0." 92 kJ·mol-1
H2(l) ΔH="-0." 92 kJ·mol-1
O2(g) O2(l) ΔH="-6.84" kJ·mol-1
O2(l) ΔH="-6.84" kJ·mol-1
H2O(l) H2O(g) ΔH="+44.0" kJ·mol-1
H2O(g) ΔH="+44.0" kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:
参考答案:(1)①1 mol H2分裂为H、0.5 mol O2分裂为O时吸收的热量;H、O结合生成1 mol H2O(g)放出的热量;1 mol H2和0.5 mol O2生成1 mol H2O(g)时,反应放出的热量;②放热 <;(2)相同质量时,氢气放出的热量多 产物为水,无污染(其他合理答案均可);(3)H2(l)+O2(l) H2O(g) ΔH="-237.46" kJ·mol-1。
H2O(g) ΔH="-237.46" kJ·mol-1。
本题解析:
试题解析:(1)图象中可以分析判断,a代表旧键断裂吸收的能量;c为反应生成化学键放出的热量减去反应断裂化学键吸收的热量,即c代表反应热;(2)反应物的能量高于生成物的能量,依据化学反应的能量守恒,反应是放热反应,焓变小于0;(2)氢气在氧气中可以燃烧可以放出大量的热,氢气的燃烧产物是水,不污染环境;(3)已知:①H2(g)+1/2O2(g)
本题难度:困难