时间:2017-08-06 10:23:40
1、实验题 某化学课 外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。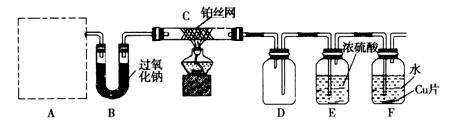
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有__________________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
A.施用该物质会大大提高粮食产量而对环境无影响
B.向该物质的溶液中加入足量氢氧化钡溶液发生反应的离子方程式为:NH4+ + OH– = NH3?H2O
C.可通过加热方法区别该试剂和(NH4)2SO4
D.工业上用NH3等合成该物质的过程可称为氮的固定
(3)装置C中发生催化氧化反应的化学方程式为_________________________,装置E发生反应的化学方程式为_________________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
___________________________________________________________________ __。
__。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:_____________________________________________________________________________________ ____________________________________________________________。
____________________________________________________________。
2、实验题 (13分)I.某校化学实验小组探究浓度对化学反应速率的影响,并测定(NH4)2S2O8和KI反应的化学反应速率。进行如下实验探究:
【实验原理】
(NH4)2S2O8和KI反应的离子方程式为:S2O82-+ 2I-= 2SO42-+ I2?(1)
平均反应速率的计算式为v(S2O82-)=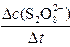 。
。
实验时,向KI、Na2S2O3和淀粉指示剂混合溶液中加入(NH4)2S2O8溶液,不断搅拌。
在反应(1)进行的同时,发生反应:2S2O32-+ I2 ="?" S4O62-+ 2I-?(2)
反应(1)生成的I2立即与S2O32-反应,生成无色的S4O62-和I-。S2O32-耗尽时,反应(1)继续生成的I2才与淀粉作用呈现蓝色。从加入(NH4)2S2O8溶液到出现蓝色的时间为Δt。
【实验内容】
(1)实验小组设计的实验记录表和数据记录如下,请将表中字母表示的空格填上。
| 实?验?编?号 | ① | ② | ③ | ④ | ⑤ | |
| ? 试剂 用量 (mL) | 0.20? mol·L-1(NH4)2S2O8溶液 | 20.0 | 10.0 | ?b | 20.0 | 20.0 |
| 0.20? mol·L-1 KI溶液 | 20.0 | 20.0 | 20.0 | 10.0 | 5.0 | |
| 0.010? mol·L-1 Na2S2O3溶液 | ?a | 8.0 | 8.0 | 8.0 | 8.0 | |
| 0.2% 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 0.20? mol·L-1KNO3溶液 | 0 | 0 | 0 | 10.0 | ?c | |
| 0.20? mol·L-1(NH4)2SO4溶液 | 0 | 10.0 | 15.0 | 0 | 0 | |
| 20 ℃时,反应时间Δt(s) | 32 | 67 | 130 | 66 | 135 | |
| 为了使溶液的离子强度和总体积保持不变,减少的(NH4)2S2O8溶液或KI溶液的用量,分别用(NH4)2SO4溶液或KNO3溶液补足;溶液混合后体积不变 | ||||||

3、选择题 学习化学不限于书本和实验室,成功的关键在于如何激发自己对于自然现象的兴趣,学习并逐步掌握( )的方法和养成良好科学习惯.
A.观察
B.科学探究
C.思考
D.交流
4、简答题
工业上常用铁质容器盛装冷浓硫酸,为研究铁质材料与热浓硫酸的反应,某学校学习小组进行以下探究实验:
[一](1)将已除去表面氧化物的铁钉(碳素钢)放入冷的热的浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是??;
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。①甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,应选用?
(选填序号)
a.KSCN溶液和氯水 .b铁.粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应SO2+Br2+2H2O═2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g由于此推知气体Y中SO2的体积分数为?;
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体,为此设计了下列探究实验装置(图中夹持仪器省略)
(3)装置B中试剂的作用是??;
(4)认为气体Y中还含有Q的理由是?;(用化学方程式表示)
(5)为确认Q的存在,需在装置中添加M于??(选填序号)
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验的现象应是?;
(7)若要测定限定体积气体Y中H2含量(标准状况下约有28ml H2),除用测量H2体积方法外,否选用质量称量方法?做出判断并说明理由??。
5、实验题 某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。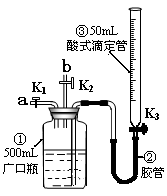
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作:?;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作:?;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是?,写出对应现象的化学反应方程式?、?;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i?当通入氧气的体积为1/2V时,则广口瓶①的气体体积为?;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为?mol/L。