时间:2017-07-10 20:39:19
1、选择题 下列过程中属于物理变化的是
①白色的硫酸铜粉末久置于空气中变成蓝色?
②同素异形体之间的相互转化?
③胶体的电泳?
④十水合碳酸钠的风化?
⑤氯化钠溶液通电后导电?
⑥给装有氯化铵的试管加热,管口又有白色晶体产生?
⑦某些金属的焰色反应.
A.只有②③⑥
B.只有①③⑦
C.只有③⑦
D.只有③⑤⑦
2、选择题 有关下图所示化合物的说法不正确的是?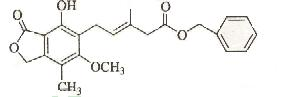
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
C.可以催化加氢
D. 1mol该物质最多可与7mol H2反应
E.该化合物有4种官能团
F.可以使酸性KMnO4溶液褪色
3、选择题 含下列离子的溶液均不能大量共存,但原因不是发生氧化还原反应的是
①.H3O+、NO3-、Fe2+、Na+;②.Fe3+、NO3-、I-、K+;③.K+、Na+、H+、S2O32-;④.Cu2+、NH4+、Br-、OH-.
A.①
B.②
C.③
D.④
4、选择题 下列电离方程式错误的是
A.Al2(SO4)3=2Al3++3SO42-
B.NaHCO3=Na++H++CO32-
C.Ba(OH)2=Ba2++2OH-
D.NaHSO4=Na++H++SO42-
5、选择题 下列关于常见的有机物的说法中不正确的是
A.乙酸和油脂都能与NaOH溶液反应
B.苯和甲烷都不能使酸性高锰酸钾溶液褪色
C.乙烯和甲烷不能用溴的四氯化碳溶液鉴别
D.糖类和蛋白质都是人体重要的营养物质