时间:2017-07-10 18:53:14
1、简答题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH 甲 0.2 0.2 pH=a 乙 c 0.2 pH=7 丙 0.2 0.1 pH>7 丁 0.1 0.1 pH=9 |
2、选择题 常温下,下列各溶液中微粒的物质的量浓度关系正确的是?
[? ]
A.0.1mol·L-1的Na2CO3溶液中:c(Na+)=c(CO32- )+?c(HCO3-)+c(H2CO3) ?
B.pH=11的Na2CO3溶液中:c(Na+)?-?c(CO32- )?- c(HCO3-)=10-3
C.浓度分别为0.1?mol·L-1和0.01?mol·L-1的CH3COOH溶液中,CH3COO-离子浓度前者大于后者的10倍 ?
D.0.1?mol·L-1的NH4Cl溶液与0.1mol·L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(OH-)>c(NH4+)>c(H+)
3、选择题 常温下,下列各组数据中比值为2:1的是( ? )
A.Na2CO3溶液中c(Na+)与c(CO32-)之比
B.0.2mol?L-1的CH3COOH溶液与0.1mol?L-1的盐酸中c(H+)之比
C.pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比
4、选择题 25℃时,某一元酸(HB)的盐NaB的水溶液呈碱性,下列叙述正确的是
[? ]
A.HB的电离方程式为:HB==H++B-
B.NaB溶液中:c(Na+)>c(B-)>c(H+)>c(OH-)
C.NaB溶液中存在如下关系:c(Na+)+c(H+)==c(HB)+c(B-)
D.0.1mol/L NaB溶液中水电离的OH-浓度大于10-7mol/L
5、填空题 常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题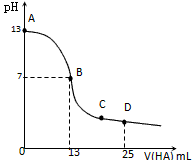
(1)写出MOH的电离方程式_________________________
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)___________________;此时,混合溶液中由水电离出的c(H+)_____ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点______________;C点_____________;
(4)D点时,溶液中c(A-)+c(HA)________2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的
pH=3,则c(HA) + c(H+) = __________mol/L。