时间:2017-03-05 15:17:15
1、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.室温下,向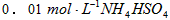 溶液中滴加
溶液中滴加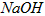 溶液至中性:
溶液至中性:
?B.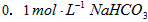 溶液:
溶液: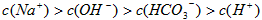
C.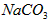 溶液:
溶液:
D.25℃时,pH=4.75、浓度均为0.1mol/L的 混合溶液:
混合溶液: 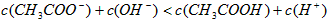
2、选择题 200mL?0.1mol?L-1的氯化铁溶液和100mL?0.1mol?L-1的硝酸银溶液混合后,混合溶液中各种离子浓度从大到小的顺序正确的是( )
A.c(Cl-)>c(Fe3+)>c(Ag+)>c(NO3-)
B.c(Cl-)>c(Fe3+)>c(NO3-)>c(Ag+)
C.c(Fe3+)>c(Cl-)>c(NO3-)>c(Ag+)
D.c(NO3-)>c(Fe3+)>c(Ag+)>c(Cl-)
3、选择题 物质的量浓度相同的下列溶液,pH由大到小排列正确的是?
[? ]
A.Ba(OH)2、Na2SO3、FeCl3、KCl?
B.Na2SiO3、Na2CO3、KNO3、NH4Cl?
C.NH3·H2O、Na2SO4、H2SO4、H3PO4?
D.NaHCO3、Na2CO3、C2H5OH、HCl
4、填空题 已知①25℃时,难溶电解质的溶度积常数:Ksp(CaC2O4)=2×10-9,②25℃时,100?mL?0.4?mol·L-1?H2C2O4水溶液中,用KOH固体来调节溶液pH(忽略体积变化),得到H2C2O4、HC2O4-、C2O42-三种微粒含量与溶液pH的变化关系如图所示。? 
请回答下列问题:
(1)?pH=5.2时,H2C2O4、HC2O4-、C2O42-浓度从大到小依次是__________。
(2)向水中加入KHC2O4固体会使水的电离平衡向_______ 移动,解释其原因是__________。
(3)将500?mL0.2mol·L-1?H2C2O4与500?mL0.2mol·L-1 ?K2C2O4混合,关于所得溶液的下列关系式中错误的是?(? ?)
A.c(K+)>c(H+)>c(C2O42-)>c(H2C2O4)
B.c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)
C.c(K+)=2c(HC2O4-)+2c(C2O42-)+2c(H2C2O4)
D.?c(C2O42-)>c(H2C2O4)>c(HC2O4-)
(4)?25℃时向1L1×10-4?moI/L?H2C2O4溶液中加入1× 10-4?mol?CaCl2固体,调节溶液pH=9,请通过计算判断是否产生白色沉淀?_________(填“是”“否”或“无法确定”)。 ?
(5)为了测定血液中的钙离子含量,通常向样品中加入K2C2O4使之转化为CaC2O4沉淀,再向过滤出的沉淀中加入 ?过量的硫酸将沉淀转化为H2C2O4,最后用高锰酸钾溶液滴定。请写出滴定时发生反应的离子方程式:_____________。
5、选择题 氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l)?△H=-67.7kJ/mol
②H+(aq)+OH-(aq)=H2O(l)?△H=-57.3kJ/mol
在20mL,0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,下列有关说法正确的是?
[? ]
A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq)?△H=+10.4kJ/mol
F-(aq)+H+(aq)?△H=+10.4kJ/mol
B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+)
C.当V=20时,溶液中:c(F-)c(Na+)=0.1mol/L
D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>?c(H+)