时间:2017-01-24 18:47:41
1、选择题 下列溶液中微粒的物质的量浓度关系正确的是[???? ]
A.0.lmol/L的NH4Cl溶液与0.05mol/L的NaOH溶液等体积混合后的溶液:c(Cl-)>c(Na+)>c(NH4+)> c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) +c(CO32-)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)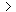 c(OH-)=c(H+)
c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(A2-)=c(H+)+c(H2A)
参考答案:BD
本题解析:
本题难度:一般
2、选择题 下列有关说法正确的是(???)
A.熔融氢氧化钠能导电是由于熔融状态下氢氧化钠电离成Na+、O2-和H+
B.硫酸氢铵的电离方程式为NH4HSO4=NH4++H++SO42-
C.盐酸溶液能导电是由于热熔化条件下,氯化氢电离成H+和Cl-
D.电离时生成的阳离子全部是H+的化合物一定是酸
参考答案:B
本题解析:氢氧化钠固体中含有Na+和OH-,故电离时应电离出Na+和OH-,所以A项错误;盐酸溶液中HCl在水的作用下的电离,故C项错误;H2O也是电离时生成的阳离子全部是H+的化合物,故D项错误。
本题难度:简单
3、选择题 把0.05mol?NaOH固体分别加入下列100mL液体中,溶液的导电性基本不变的是
A.自来水
B.0.5mol?L-1的盐酸
C.0.5mol?L-1的醋酸
D.0.5mol?L-1的氨水
参考答案:B
本题解析:分析:溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化,B项中物质均是强电解质,加入NaOH后生成物仍是强电解质,故导电性变化不大;A、C、D项中物质由于难电离,离子浓度很小,当加入NaOH后,离子浓度增大很多,成为强电解质,故导电能力与原来相比变化很大.
解答:导电能力的大小,要比较单位体积内离子浓度的多少.
A、因水是极弱的电解质,导电性极弱,加入氢氧化钠后,氢氧化钠是强电解质,溶液中主要的是钠离子和氢氧根,导电性增强,故A错误;
B、未加氢氧化钠固体,导电的有氯离子和氢离子,加入氢氧化钠后主要是钠离子,氯离子,未反应的氢离子,而参加反应的氢离子正好与钠离子的量相当,所以导电性变化不大,故B正确;
C、原来醋酸是弱电解质,离子较少,加入强碱以后,变为强电解质,导电能力增强,故C错误;
D、一水合氨属于弱电解质,加入NaOH后即加入了强电解质,离子的浓度变化大,故导电性变化较大,故D错误;
故选B.
点评:本题考查溶液中离子浓度大小比较,以此判断溶液的导电性,溶液混合后导电能力变化的大小,关键是看混合后溶液中自由移动的离子浓度的变化.
本题难度:简单
4、选择题 下列物质中,属于电解质的是
A.浓硫酸
B.Al
C.蔗糖
D.HCl
参考答案:D
本题解析:电解质为在水溶液和熔融状态下能导电的化合物。故只有HCl;浓硫酸为混合物,Al单质。故既不是电解质也不是非电解质。蔗糖为非电解质。
本题难度:困难
5、选择题 某学生用下列溶质配制一种混合溶液,已知溶液中c(Na+)=2c(SO42-)=2c(K+)=2c(Cl-),则溶质可能是( ? )