9.2
回答下列问题:
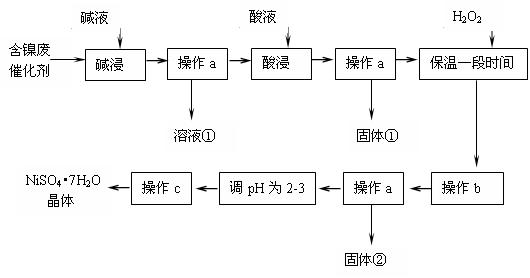
⑴操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为???????????????????????????????。
⑵“碱浸”过程中发生的离子方程式是????????????????????????????????。
⑶“酸浸”时所加入的酸是??????????????? (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是??????????????????????????。
⑷操作b为调节溶液的pH,你认为pH的最佳调控范围是???????????????。
⑸“调pH为2~3”的目的是?????????????????????????????????????????。
⑹产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是??????????????。
参考答案:(每空2分,共14分)
⑴漏斗、蒸发皿
⑵ 2A
本题解析:略
本题难度:简单
3、实验题 (14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
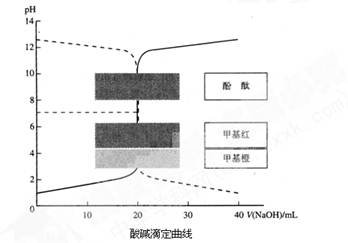
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中??????(填“实线”或“虚线”)。

(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是???????????????????和?????????????????。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于??????????????(填仪器名称)中,用蒸馏水稀释10倍。
B.用??????????????????(填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入????????????(填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视?????????????????;终点现象是????????????????????????????。
②误差分析:下列操作中能使测定结果偏高的是????????????????????????。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是?????????????????。
参考答案:(14分)
(1)虚线????(2分)???????(
本题解析:考查酸碱中和滴定
(1)向一定量的NaOH溶液中滴加HCl溶液时,混合溶液的pH逐渐减小,故符合虚线
(2)设X和Y的物质的量浓度分别CX、CY,根据图示可得到以下两等式:
0.01CX=0.03CY??? 0.01=(0.01CX—0.02CY)/0.03
解得:CX=0.09 mol·L?1、CY=0.03 mol·L?1
(3)A:精确的配制、稀释溶液的容器为容量瓶
B:精确量取酸性液体可采用酸式滴定管;由于用强碱滴定弱酸,中和时溶液水解呈碱性,最好采用变色范围为碱性区域的指示剂,即酚酞
C:①酸碱滴定时,左手握活塞,右手旋转锥形瓶,两眼注视锥形瓶中溶液颜色的变化;
终点现象是溶液由无色变为浅红色,且在30s内不褪色
②a.蒸馏水消毒时一般用氯气,形成酸性物质,故将消耗的碱液偏多,测定结果偏高
b.盛NaOH溶液的碱式滴定管未用标准液润洗将使标准液的浓度偏小,标准液的体积偏大,测定结果偏高
c.滴定前读数正确,滴定终点时俯视读数,将使标准液的体积偏小,测定结果偏低
d.无影响
③制造商加水过度稀释等
本题难度:一般
4、实验题 (4分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
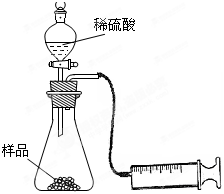
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
A.[(b-a)/84]×22.4×1000 mL
B.[(b-c)/31]×22.4×1000 mL
C.[(c-a)/106]×22.4×1000 mL
D.[(c-a)/106]×2×22.4×1000 mL
参考答案:(1)Na2CO3(1分)(2)ABD(3分,答对一个给1分
本题解析:(1)NaHCO3受热会发生会发生如下反应:2NaHCO3?→ Na2CO3?+?CO2 ?↑+?H2O,其中CO2?气体跑出,水也会蒸发掉。只剩下Na2CO3固体。
(2) 由题意可知(b-a)为Na2CO3质量,则[(b-a)/84]×22.4×1000 mL为NaHCO3体积。所以选项A正确。由(1)可知冷却后的总质量其实是Na2CO3和蒸发皿质量,所以(c-a)就是Na2CO3质量。由化学方程式可知[(c-a)/106]×2就是NaHCO3物质的量,可算出[(c-a)/106]×2×22.4×1000 mL为NaHCO3体积。所以选项D正确。有题意可知(b-c)为NaHCO3与Na2CO3质量之差。由
2NaHCO3?→ Na2CO3?+?CO2 ?↑+?H2O??? Δn
2?????????????????????????????????? 1
n(NaHCO3)??????????????????????? (b-c)/62
可算出(b-c)/31就是NaHCO3物质的量,则[(b-c)/31]×22.4×1000 mL为NaHCO3体积。所以选项B正确。
本题难度:简单
5、实验题
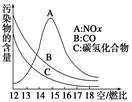
稀薄燃烧是指汽油在较大空气/燃比(空气与燃油气的体积比)条件
下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的
重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为
N2。不同空/燃比时汽车尾气中主要污染物的含量变化如图所示。
(1)稀薄燃烧技术除能节约能源外,还具有的优点是??????????????????(填一项)。排放到大气中的NOx会导致酸雨、????????????等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
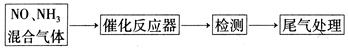       
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,
需要测量并记录的数据是???????????????。
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是??????(填字母),原因是????????????????。
A.①????????????????????? B.②??????????????????? C.都有可能
参考答案:(1)减少CO和碳氢化合物的污染???光化学烟雾或破坏臭氧层
本题解析:本题以燃油气燃烧过程产生污染这一社会关注问题为背景,考查了环保知识和探究催化剂性能的过程及问题分析,这是一道开放性、探究性很好的试题,侧重考查了学生的自学能力、分析探究问题的能力,要求学生平日要善于思考和分析,关注社会热点,善于运用所学知识解释和解决生活中遇到的实际问题、做到理论联系实际。
(1)因燃油气燃烧过程中可产生对空气有污染的CO、NOx、碳氢化合物等大气污染物,结合“空/燃比”的含义和题图可以推知,增大“空/燃比”可以减少CO、碳氢化合物的排放从而减少污染,根据课本知识可推出排放到大气中的NOx可导致酸雨及光化学烟雾(或破坏臭氧层)而引起环境污染。
(2)因实验的目的是探究催化剂的催化性,而从所给的探究步骤中,有滴有酚酞的稀硫酸(该溶液为无色),所以肯定是利用NH3与硫酸的酚酞溶液作用显红色的快慢来检测催化性能。只要记录显色所需时间即可。
(3)根据氧化还原反应中电子得失守恒原则可推知,若汽车尾气中会有一定量的CO和碳氢化合物,因它们也可以还原NOx,则所消耗氨气就少,若汽车尾气中含NO2,则因NO2也可氧化NH3,则消耗的氨气就多。
本题难度:一般
|