3~4
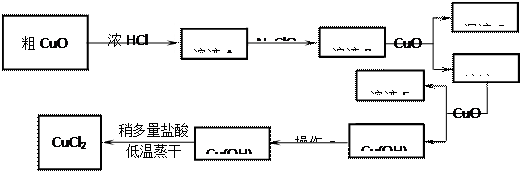
⑴溶液A中加入NaClO的目的是????????????????????????????????????;
⑵在溶液B中加入CuO的作用是????????????????????????????????????;
⑶操作a的目的是?????????????????????????????????????????????????;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是????????????????????????????????????????????。
参考答案:⑴?将Fe2+氧化为Fe3+而使分离更加完全
⑵调节溶
本题解析:略
本题难度:一般
2、填空题 (6分)
氯碱工业中,阳极的电极反应式为????????????????????????,阴极产物为??????????;若用石墨电极电解CuSO4溶液,阴阳两极均产生2.24 L气体(标准状况),则析出Cu?????g。
参考答案:
2Cl—2e-=Cl2↑(2分);? H2、NaO
本题解析:略
本题难度:简单
3、选择题 下列物质的制备,符合工业生产实际的是
A.电解饱和氯化钠溶液制备金属钠
B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱
C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸
D.将SO2和O2的混合气加压后,通过接触室制备SO3
参考答案:B
本题解析:
试题分析:A、电解饱和氯化钠溶液,生成NaOH,错误;B、侯氏制碱法,正确;C、HCl直接用水吸收,错误;D、接触法制硫酸为常压下进行,错误。
本题难度:一般
4、选择题 下列关于化工生产原理的叙述中,均符合目前工业生产实际的是
A.氯碱工业中,电解槽的阳极区产生NaOH
B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
C.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高
D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸
参考答案:
C
本题解析:
本题考查化学工业有关的化学知识,本题关键要明确化工原理及反应原理。在阴极得到H2,破坏了水的电离平衡,留下OH-?,故应在电解槽的阴极区产生NaOH,A错;工业制盐酸是用H2在Cl2中燃烧得到氯化氢,用水吸收得到盐酸,B错;N2、H2经循环使用,绝大部分转化成了氨,故氨的产率很高,C正确;三氧化硫在吸收塔内用水吸收易产生酸雾,不利于吸收,同时易损坏设备,故工业上三氧化硫被浓硫酸吸收,D错。
本题难度:一般
5、填空题
⑴配平反应器中发生的反应方程式:
I2 + ???KIO3 + ???H2O="=" ???KH(IO3)2 + ???KCl + ???Cl2↑
⑵步骤②中,用硝酸而不用HI,其原因可能是????????????????????????????????????
⑶步骤③要保持溶液微沸1小时,以完全排出氯气,排出氯气的原因为?????????????????
?????????????????????????????????????????????????????????????????????????????
⑷合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有???????????
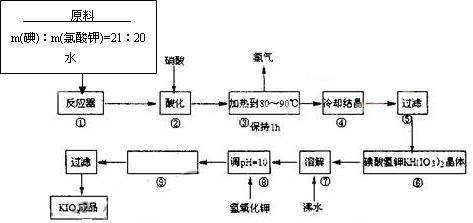
⑸用氢氧化钾调节溶液的PH值,发生的反应方程式为:
????????????????????????????????????????????????????????????????????????????
⑹参照碘酸钾溶解度曲线,步骤得到碘酸钾晶体,你建议的方法是?????????????????????
温度
| 0
| 10
| 20
| 40
| 60
| 80
| KIO3g/100g水
| 4.60
| 6.27
| 8.08
| 12.6
| 18.3
| 24.8
参考答案:(每空2分)(1)6,11,3=6,5,3;(2)HI具有还
本题解析:该题以KIO3制备实验为载体,考查了氧化还原反应及其方程式配平,过滤实验的仪器、物质的分离方法等。图、表结合,考查学生的阅读理解能力。(1)略(2)HI有较强还原性,IO3-有较强氧化性,二者发生反应:5I-+IO3-+6H+==3I2+3H2O,所以不能用HI酸化;(3)因为ClO-有强氧化性能将KIO3氧化成KIO4,故在加KOH之前要予以排除。(4)、(5)略(6)由表中数据可知KIO3在常温下的溶解度较小,又KIO3在650℃即分解,故最好采用蒸发浓缩溶液,让KIO3结晶析出再行过滤分离的方法。
本题难度:一般
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|  ?
?