1、填空题 在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH 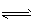 CH3COO-+H+ ; △H>0
CH3COO-+H+ ; △H>0
(1)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是____。
a.加入少量0. 10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0. 010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0. 10 mol·L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5。现有:
①0. 10 mol·L-1 CH3COOH溶液②0.001 0 mol·L-1 CH3COOH溶液
其c(H+)之比为①:②=____。[提示:进行简化计算,平衡时的 c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
(3)25℃时,向0.10 mol·L-1 CH3COOH溶液中加入一定量固体CH3 COONa (假设溶液体积不变),若溶液中c(CH3COO-)为1.0 mol·L-1,则溶液中 c( H+)=____mol·L-1(计算结果保留小数点后两位有效数字)。溶液中各种离子浓度关系是___。
参考答案:(1)bcf
(2)10 : 1
(3)1.
本题解析:
本题难度:一般
2、选择题 室温下,一元酸HA溶液与一元碱BOH溶液等体积混合,下列有关判断正确的是( )
A.若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱
B.若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸
C.若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱
D.若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足:C(B+)>C(A-)>C(H+)>C(OH-)
参考答案:C
本题解析:
本题难度:简单
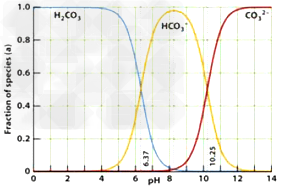
3、选择题 下图是一水溶液在PH从0至14的范围内,H2CO3、HCO3-?、CO32-?三种成分平衡时的组成百分率,下列叙述正确的是
 [???? ]
[???? ]
A.等体积的1.0mol·L-1?HCl溶液和1.0mol·L-1碳酸钠溶液混合时呈中性
B.在pH为6.37及10.25时,溶液中c(H2CO3)=?c(HCO3-)=?c(CO32-)
C.若用CO2和NaOH反应制取Na2CO3,溶液的pH必须控制在12以上
D.此图是1.0mol/L碳酸钠溶液滴定1.0?mol/LHCl溶液的滴定曲线
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列物质中,属于电解质的是
A.稀盐酸
B.Cu丝
C.NaCl
D.蔗糖
参考答案:C
本题解析:电解质必须符合下列条件:1、在水溶液中能导电的物质必须是原物质,不能是与水反应后的物质;2、必须是化合物
A、稀盐酸是混合物,故A错误.
B、铜丝是单质,所以既不是电解质也不是非电解质,故B错误.
C、虽然氯化钠溶液中有自由移动的离子,能导电,故C正确.
D、蔗糖是有机物,其水溶液或熔融态都没有离子存在,所以不导电,是非电解质,故D错误.
故选C.
本题难度:困难
5、选择题 把0.05molBa(OH)2固体分别加入到下列100mL液体中,溶液导电性基本不变。该液体是?????[???? ]
A.自来水?????
B.1.0mol/L盐酸?????
C.0.5mol/L硫酸??????
D.1.0mol/L氨水
参考答案:B
本题解析:
本题难度:一般
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
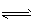 CH3COO-+H+ ; △H>0
CH3COO-+H+ ; △H>0