时间:2017-01-16 16:05:40
1、选择题 SiCl4的分子结构与CCl4类似,对其作出如下推测,其中不正确的是
A.SiCl4晶体是分子晶体
B.常温常压下SiCl4是气体
C.SiCl4的分子是由极性键形成的非极性分子
D.SiCl4熔点高于CCl4
参考答案:B
本题解析:SiCl4的分子结构与CCl4类似,应是由极性键形成的非极性分子,固态时为分子晶体;由于SiCl4的相对分子质量大于CCl4的相对分子质量,则SiCl4晶体中,分子间的分子间作用力大于CCl4间的分子间作用力,故SiCl4的熔、沸点高于CCl4;由于CCl4为液态,故SiCl4不可能为气态,只可能是液态或固态.
本题难度:简单
2、选择题 下列有关实验的描述中,正确的是
①钠放入水中后,沉在水下缓缓冒出气体
②过氧化钠与水反应放出大量热
③氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰
④将某气体通入品红溶液中,红色褪去,说明该气体一定是SO2
⑤向某溶液中加入烧碱溶液,加热后生成使湿润红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
A.②⑤
B.④⑤
C.①③
D.③④
参考答案:A
本题解析:试题分析:①钠的密度比水小,漂在水上面,故错;③氢气在氯气中燃烧时是苍白色火焰,故错;④如果对褪色的品红溶液加热,溶液颜色恢复,则是SO2,故错。故选A。
考点:实验现象的观察和记录
点评:本题较综合的考查了物质与氧气,二氧化硫的性质,铵盐的性质,钠、过氧化钠与水反应的相关知识,掌握所学知识即可顺利解答。
本题难度:困难
3、选择题 下列实验操作中错误的是?????????????????????????????????????
A.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B.进行称量操作时,应将称量物放在托盘天平的左盘,砝码放在托盘天平的右盘
C.进行分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D.进行蒸发结晶操作时,应将溶液蒸干
参考答案:D
本题解析:试题分析:D、蒸发结晶不一定要蒸干,而且一般都不蒸干,因为溶液中会有杂质离子,如果蒸干的话,杂质也会跟着析出,从而降低纯度,故错。故选D。
考点:化学实验操作
点评:本题考查的是化学实验操作的相关知识,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:困难
4、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是: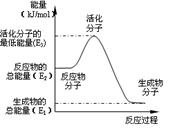
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)? △H1=+ 49.0 kJ·mol -1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)? △H2=-192.9 kJ·mol -1
下列说法正确的是
A.根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ
B.反应②中的能量变化如右图所示,则△H2= E1- E3
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.CH3OH的燃烧热△H=-192.9 kJ·mol -1
参考答案:A
本题解析:根据②推知:在25℃,101 kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9 kJ ,因为还要包括氢气继续燃烧放出的热量,故A正确,D错误。反应②中的能量变化△H2= E1- E2,B错误;由反应②推知CH3OH转变成H2的过程可以释放能量,C错误;
本题难度:一般
5、选择题 下列关于化学键说法正确的是:
A.构成单质分子的微粒中不一定含有化学键
B.只含有共价键的物质一定是共价化合物
C.NaCl溶于水破坏了离子键,乙醇溶于水破坏了共价键
D.CaCl2中既有共价键又有离子键
参考答案:A
本题解析:稀有气体分子的最外层电子已经达到稳定结构,所以稀有气体单质分子中不存在化学键,A正确。全部由共价键形成的化合物是共价化合物,B不正确。乙醇是非电解质,溶于水化学键不变,破坏的是分子间作用力,C不正确。钙和氯都是活泼的金属和活泼的非金属,形成的化学键是离子键,D不正确。答案选A。
本题难度:困难