时间:2017-01-16 15:53:26
1、填空题 (13分)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O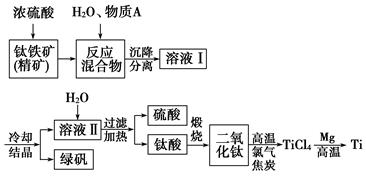
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是
_________________________,?????????????????????
(3)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是__________________
2MgCl2+Ti在Ar气氛中进行的理由是__________________
________________________________________________________________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH2=38.8 kJ·mol-1
C(s)+CO2(g)===2CO(g) ΔH3=282.8 kJ·mol-1
反应C(s)+O2(g)===CO2(g)的ΔH=________。
2、填空题 氨是一种重要的化工原料,氨的合成与应用是当今重要研究内容之一。不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2起始物质的量之比为1∶3)。
 压强(Mpa) 压强(Mpa) 氨的平 氨的平衡含量(%) 温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 | ||||||||||||
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 9 5.4 5.4 | 98.8 | ||||||||||||
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 | ||||||||||||
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 | ||||||||||||
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 | ||||||||||||
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 回答下列有关问题: (1)利用表中数据推断得出合成氨的反应是__________反应(填“放热”、“吸热”或“无热量变化”)。 (2)根据表中数据,在200℃和100MPa时,平衡体系中NH3的物质的量分数最高,而实际工业生产不选用该条件的主要原因是___________________________________。 (3)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“可能增大也可能减小”):
|