时间:2025-06-26 03:27:11
1、选择题 若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是 (?)
A.SO42-
B.S2-
C.CO32-
D.Cl-
参考答案:BC。
本题解析:跟甲基橙作用呈红色,说明溶液显酸性,在酸性溶液中,S2-与CO32-不能大量存在。
本题难度:简单
2、选择题 下列各组中的离子能大量共存的是( )
A.H+、Na+、NO3-、SiO32-
B.NH4+、K+、Cl-、OH-
C.Mg2+、NH4+、NO3-、SO42-
D.K+、H+、SO32-、ClO-
参考答案:A.因H+、SiO32-能结合生成硅酸沉淀,则不能共存,故A错误;
B.因NH4+、OH-能结合生成弱电解质,则不能共存,故B错误;
C.该组离子之间不反应,则能够共存,故C正确;
D.因H+、SO32-能结合生成水和气体,H+、ClO-能结合生成弱电解质,则不能共存,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 某溶液A只含有NH4+、Na+、Mg2+、Al3+、CO32-、SO42-中的几种,若取A溶液加入Na2O2粉末,有无色无味的气体放出,并生成白色沉淀,加入Na2O2的量为X,生成沉淀的量为Y,则有如右图所示关系,可知: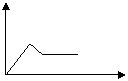 ?
?
(1)A中一定有__________离子?
(2 ) A中一定没有___________离子?
(3 ) A中可能有_____________离子?
参考答案:(1):Mg2+、Al3+?、SO42-?
(2):NH4+、CO32-
(3):Na+
本题解析:加入Na2O2粉末,放出有无色无味的气体,说明溶液中不含NH4+;有白色沉淀生成,说明一定有Mg2+、Al3+中的一种或二种;CO32-会同Mg2+、Al3+发生反应,说明一定没有CO32-;根据加入Na2O2的量与生成沉淀量的图所示关系,可知溶液A中一定有Mg2+、Al3+?。这样溶液A中现可以肯定的是:一定有Mg2+、Al3+,一定没有NH4+、CO32-。Na+和SO42-从实验现象还不能确定是否存在,但根据溶液呈电中性的原理,A溶液中一定存在SO42-。
本题难度:简单
4、选择题 由反应物粒子一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现的:
①Ce4++Mn2+→Ce3++Mn2+
②Ce4++Mn3+→Ce3++Mn4+
③Ti4++Mn4+→Ti3++Mn2+
由此可知,该反应的催化剂是(?)
A.Ce4+
B.Ti3+
C.Mn3+
D.Mn2+
参考答案:D
本题解析:催化剂参加化学反应,但反应前后物质的种类和数量不变,只有Mn2+符合题意。
本题难度:一般
5、选择题 下列关于电解质溶液的正确判断是
[? ]
A.在pH = 12的溶液中,K+、Cl-、HCO3-、Na+可以常量共存
B.在pH=0的溶液中,Na+、NO3-、SO32-、K+可以常量共存
C.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液存在A-+H2O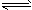 HA+OH-
HA+OH-
D.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH-
参考答案:C
本题解析:
本题难度:一般