时间:2025-06-26 03:23:06
1、选择题 (4分)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)
现将溶液两两混合,记录现象如下:
A+B→白色沉淀;B+ D→白色沉淀;C+D→蓝色沉淀
则(1)A、B、C、D的化学式分别是_________、__________、___________、_________。
(2)分别写出下列反应的离子方程式
A+B→
B+ D→
C+D→
2、填空题 (1)向硫酸氢钠溶液中,逐滴加入Ba(OH)2溶液至中性。请写出发生反应的化学方程式: ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 ;
3、选择题 下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+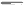 4Fe3++2H2O
4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO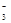 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO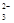 +2H2O
+2H2O
C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO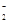 +4NH
+4NH +2H2O
+2H2O
4、填空题 由氯化铁溶液制备胶体的化学方程式为_______________________________.
5、填空题 (共12分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)Z原子的原子结构示意图为 ;
(2)化合物甲由元素X与Y组成,1mol甲含18mol电子,请写出甲的电子式: ;
(3)由X、Y、Z、W四种元素组成的一种正盐,该盐的水溶液呈酸性,用离子方程式解释原因: 。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与氯水反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式 。
(5)用亚硝酸氧化化合物甲,可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%,该氢化物的分子式为 。该氢化物受撞击时完全分解为氮气和氢气,则2.15g该氢化物受撞击后产生的气体在标况下的体积为 L。