时间:2025-06-26 03:14:13
1、填空题 (14分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是 。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是 ,还原剂是 _,BrFx中的x=____________。
(3)浓盐酸在反应KClO3+HCl
2、选择题 下列化学用语使用正确的是(? )
A.葡萄糖、淀粉的最简式都是CH2O
B.CH4的电子式是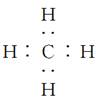
C.乙醛分子的结构简式是CH3COH
D.丙烷分子的球棍模型是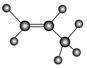
3、选择题 下列变化中属于物理变化的是
A.剩饭变馊
B.自行车生锈
C.牛奶变酸
D.电灯发光
4、选择题 下列有关物质结构的表述正确的是?( )
A.次氯酸的电子式: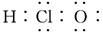
B.氮原子轨道表示式为
C.硫原子的最外层电子排布式为3s23p4
D.钠离子的结构示意图:
5、选择题 下列实验现象与氧化还原反应有关的是
A.蘸有浓盐酸和浓氨水的玻璃棒互相靠近,产生大量白烟
B.向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成
C.将装有NO2 的试管倒立于水中,管内气体由红棕色逐渐转变为无色
D.硫酸铁溶液中滴加硫氰化钾溶液变红