时间:2025-06-26 00:34:07
1、推断题 已知M和R是两种常见的金属单质,其中M为红色。它们在一定条件下有如下转化关系,Q溶液呈红色。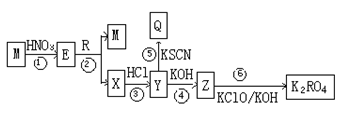
请根据上述框图回答有关问题:
(1)上述转化关系中,属于非氧化还原反应的是?(填序号)。
(2)分别写出③、⑥对应的离子方程式?、?。
(3)K2RO4是一种新型绿色净水剂,请写出该净水剂的净水原理:?。
参考答案:(每空2分,共8分)(1)④⑤
(2)3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ ?;2 Fe(OH)3+ 3ClO-+4OH-=2FeO42-+ 3Cl-+5H2O
(3)K2FeO4被还原生成的Fe3+水解生成氢氧化铁胶体,可以吸附水中的悬浮物而沉降,从而起到净水作用。
本题解析:M和R是两种常见的金属单质,其中M为红色,因此M是铜。Y和KSCN溶液反应呈红色,所以Y中含有铁离子。铜和硝酸反应生成E,E和R反应生成铜和X,X和盐酸反应生成Y,所以R是铁,X是硝酸亚铁,E是硝酸和硝酸铜的混合液,Z是氢氧化铁。
(1)上述转化关系中,属于非氧化还原反应的是④⑤,其余都是氧化还原反应。
(2)反应③是硝酸氧化亚铁离子、反应⑥是次氯酸氧化铁离子生成高铁酸钾,所以对应的离子方程式分别是3Fe2++4H++NO3-=3Fe3++2H2O+NO↑、2 Fe(OH)3+ 3ClO-+4OH-=2FeO42-+ 3Cl-+5H2O。
(3)由于K2FeO4被还原生成的Fe3+水解生成氢氧化铁胶体,可以吸附水中的悬浮物而沉降,从而起到净水作用。
本题难度:一般
2、简答题 如图为“奥运五环”,如果五元环分别代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性;E是由六个原子构成的分子,可用于火箭燃料;C是由地壳中含量最高的两种元素组成;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
(1)A、B、C、D、E的化学式分别是______.
(2).A燃烧的化学方程式为______.
(3)B的水溶液呈弱酸性,其电离方程式可表示为______.
(4)B与E反应可生成单质G和一种常见的液体H,其反应的化学方程式为______.
参考答案:圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由五种短周期元素形成,每种化合物仅含有两种元素.A是沼气的主要成分判断为CH4;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,B的水溶液呈弱酸性,含氢元素推断为H2O2;E是由六个原子构成的分子,可用于火箭燃料判断为N2H4;C是由地壳中含量最高的两种元素是氧元素和硅元素,组成的化合物推断为SiO2;D中所含的两种元素在CE中含有,C为SiO2;E为N2H4;D中原子个数之比为3:4,结合元素化合价推断可知,组成元素为+4价的硅元素和-3价的氮元素,化合物化学式为:Si3N4;综上所述分析判断各物质为:CH4、H2O2、SiO2、Si3N4、N2H4;
(1)由上述推断可知,A、B、C、D、E的化学式分别是:CH4、H2O2、SiO2、Si3N4、N2H4,故答案为:CH4、H2O2、SiO2、Si3N4、N2H4;
(2)A为甲烷燃烧的化学方程式为:CH4+2O2?△?.?CO2+2H2O,故答案为:CH4+2O2?△?.?CO2+2H2O;
(3)B的水溶液呈弱酸性是二元弱酸,电离方程式为:H2O2?HO2-+H+,故答案为:H2O2?HO2-+H+;
(4)B(H2O2)与E(N2H4)反应可生成一种常见的液体H判断为H2O和单质G推断为N2,其反应的化学方程式为:2H2O2+N2H4═N2↑+4H2O,故答案为:2H2O2+N2H4═N2↑+4H2O.
本题解析:
本题难度:一般
3、简答题 I:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们.根据以上信息回答下列有关问题:
(1)B2A4、C2A4、E2A4三种化合物的沸点由高到低的顺序为______.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,其中由四种元素组成的摩尔质量最小的一种的化学式是______.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是______;最新合成的化学式为B1C4D8的物质中同种原子的化学环境完全相同,t它是一种威力极强的炸药,推测它的结构简式是______.
II:由短周期元素组成的以下各单质和化合物之间存在图示转化关系.
(4)若A和甲均不溶于盐酸,则甲与NaOH溶液反应时每1mol甲失去 4mol?e-,写出乙转化为丁的离子方程式______
(5)若A和甲均可溶于盐酸,且A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则该氯化物的化学式为______,工业生产单质A的化学方程式为______.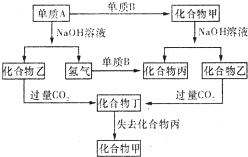
参考答案:五种短周期元素aA、bB、cC、dD、eE,已知它们的原子序数有如下关系a+b=c,a+c=d,c+d=e,自然界中B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但可以肯定没有第三种元素的化合物种数会超出它们,则B、A为C元素或H元素,a+b=c,c=1+6=7,即C为N元素;c=7,a+c=d,c+d=e,则a+14=e,若a=1,则e=15,所以A为氢元素,E为磷元素,符合题意;若=6,则e=20,E为钾元素,不是短周期元素,不符合题意.a+c=d,则d=1+7=8,则D为氧元素.
所以A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为磷元素.
(1)B2A4、C2A4、E2A4三种化合物分别为C2H4、N2H4、P2H4,都为分子晶体,相对分子质量越大,沸点越高,但由于氮元素电负性很强,所以N2H4中存在氢键,沸点相对更高,所以沸点由高到低的顺序为N2H4>P2H4>C2H4.
故答案为:N2H4>P2H4>C2H4.
(2)由以上元素中若干种组成化合物中,有许多离子化合物,离子化合物为铵盐,其中由四种元素组成的摩尔质量最小的一种的化学式是 HCOONH4.
故答案为:HCOONH4.
(3)由以上元素中若干种组成化合物中,许多可作为炸药,其中属于铵盐的一种的化学式是NH4NO3;最新合成的化学式为B1C4Ds的物质化学式应是CN4O8,CN4O8中同种原子的化学环境完全相同,它是一种威力极强的炸药,其结构为正四面体,C原子位于正四面体中心,四个顶点均连接1个-NO2,它的结构简式是
.
故答案为:NH4NO3;
.
(4)若A和甲均不溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为硅单质,乙为硅酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为二氧化硅,单质B为氧气.则A与NaOH溶液反应时每1molA失去4 mol?e-,二氧化碳过量生成碳酸氢根,所以乙转化为丁的离子方程式为SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
故答案为:4;SiO32-+2H2O+CO2=H2SiO3↓+2HCO3-.
(5)若A和甲均可溶于盐酸,由A与氢氧化钠溶液反应生成氢气,则A为铝单质,乙为偏铝酸钠,化合物甲与氢氧化钠溶液反应生成乙,则甲为氧化铝,单质B为氧气.A的某种氯化物蒸气密度约为相同条件下单质B(双原子分子)密度的8.34倍,则A的氯化物的相对分子质量为32×8.34=267,则该氯化物的化学式为Al2Cl6,工业生产单质Al为电解熔融的氧化铝,化学方程式为 2Al2O3?冰晶石?.电解4Al+3O2↑.
故答案为:Al2Cl6;2Al2O3?冰晶石?.电解4Al+3O2↑.
本题解析:
本题难度:一般
4、简答题 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
(1)写出A、C、E物质的化学式.
A______C______E______
(2)试管壁上如果沾有A,应用______洗涤.
(3)对于C:
①将C分别通入下列溶液时有何现象,并说明产生这种现象的原因.
A.澄清石灰水:现象______
原因______
B.品红溶液:现象______
原因______
②若将C和氯气等体积混合,然后通入品红溶液,现象与①有何不同______,用化学方程式或简要文字说明不同的原因______.
(4)浓的E溶液在常温下为粘稠的液体,且E具有强吸水性、强氧化性、强脱水性.则
①E表现吸水性时,可做干燥剂,下列物质可用E干燥的是______
A.氨气B.硫化氢C.氢气D.二氧化硫
②浓E溶液与铜反应时,E除了表现强氧化性外,还表现了______性.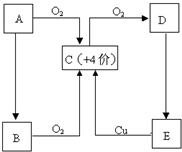
参考答案:物质A是一种淡黄色的固体,中学阶段常见有过氧化钠或硫,A能与氧气反应,则应为S,则C为SO2,由此可知D为SO3,E为H2SO4,B由A生成,与氧气反应也可生成SO2,则可知B应为H2S,
(1)由以上分析可知A为S,B为SO2,E为H2SO4,故答案为:S;SO2;H2SO4;
(2)S不溶于水,微溶于酒精,易溶于二硫化碳,可与热的氢氧化钠反应,则试管上沾有S,可用CS2或热的NaOH溶液洗涤,故答案为:CS2或热的NaOH溶液;
(3)①.A.二氧化硫可与澄清石灰水反应生成亚硫酸钙沉淀,可观察到溶液变浑浊,反应的化学方程式为SO2+Ca(OH)2=CaSO3↓+H2O,
故答案为:变浑浊;SO2+Ca(OH)2=CaSO3↓+H2O;
B.二氧化硫具有漂白性,可使品红褪色,故答案为:褪色;SO2具有漂白性;
②二氧化硫具有还原性,可与氯气发生氧化还原反应生成硫酸和盐酸,反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl,将二者混合通入品红中,溶液不褪色,
故答案为:品红不褪色;SO2+Cl2+2H2O=H2SO4+2HCl;
(4)①浓硫酸具有吸水性,可用作干燥剂,但不能干燥碱性或具有强还原性气体,可干燥二氧化硫和氢气,故答案为:CD;
②浓硫酸与铜反应生成硫酸铜和二氧化硫,反应中浓硫酸表现为酸性和强氧化性,故答案为:酸.
本题解析:
本题难度:一般
5、推断题 A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。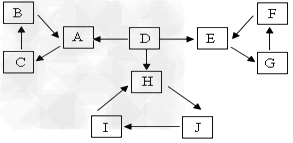
图中所有物质均有短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表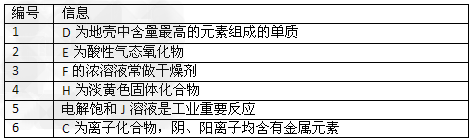
(1)写出G的化学式________,指出H中化学键类型________________
(2)常温下测得一定浓度的C溶液的PH=10,用离子方程式表示其原因_____________。
(3)写出与H式量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的电子式________________。
(4)写出C溶液中通入过量CO2的化学方程式________________。
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是________________________,该苛性钾溶液中KOH的质量________________。 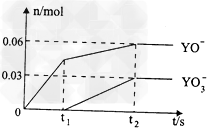
参考答案:(1)SO2或H2SO3;“略”
(2)AlO2-+2H2O Al(OH)3+3OH-
Al(OH)3+3OH-
(3)
(4)CO2 + NaAlO2 + 2H2O = NaHCO3 + Al(OH)3↓
(5)5Cl2+10OH-=2ClO-+ ClO3-+7Cl-+5H2O;16.8g
本题解析:
本题难度:一般