时间:2025-06-25 22:54:26
1、计算题 (10分)(1)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为_____,其相对分子质量为______,X的相对原子质量为________,该物质的化学式为________。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为________。(用含m的代数式表示)
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为________。
(4)20 g A物质和14 g B物质完全反应,生成8.8 g C物质、3.6 g D物质和0.2 mol E物质,则E物质的摩尔质量为________。
(5)483 g Na2SO4·10H2O中所含的Na+的物质的量是?mol,SO42—的物质的量是?mol,所含O原子的数目是?个。
参考答案:(10分,每空1分)(1)62g/mol? 62? 16? Na2O? (2)34-m? (3)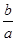 NA
NA
(4)108g/mol? (5)3? 1.5? 21NA
本题解析:考查物质的量的有关计算。
(1)12.4 g Na2X含有0.4 mol Na+,则化合物的物质的量是0.2mol,所以该化合物的摩尔质量是12.4g÷0.2mol=62g/mol;其相对分子质量是62,X的相对分子质量是62-23×2=16,所以X是O,则该化合物是Na2O。
(2)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则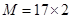 ,解得M=34,所以X原子的相对原子质量是34-m。
,解得M=34,所以X原子的相对原子质量是34-m。
(3)根据M=m/n和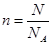 可知,X的相对原子质量可表示为
可知,X的相对原子质量可表示为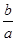 NA。
NA。
(4)根据质量守恒定律可知,E物质的质量是20g+14g-8.8g-3.6g=21.6g,所以E的摩尔质量是21.6g÷0.2mol=108g/mol。
(5)483 g Na2SO4·10H2O的物质的量是483g÷322g/mol=1.5mol,则钠离子的物质的量是3.0mol,SO42-的物质的量是1.5mol。氧原子的物质的量是14×1.5mol=21mol,原子数个数是21NA。
本题难度:一般
2、选择题 等物质的量的CH4和NH3相比较,下列结论错误的是
A.它们的分子个数比为1∶1
B.它们的原子个数比为5∶4
C.它们的电子个数比为1∶1
D.它们的体积比为1∶1
参考答案:D
本题解析:n=N/NA;A.由于微粒数与微粒的物质的量呈正比,所以它们的分子个数比为1∶1,正确, B.它们的原子个数比等于分子个数与分子内含有的原子个数的乘积的比,它们的原子个数比为(1×5):(1×4)=5∶4,正确;C.由于甲烷分子与氨气分子中都含有10个电子,所以它们的电子个数比为分子个数的比,是1:1正确;D.由于二者都是气体,气体的体积除了与物质的量的多少有关外,还与外界条件有关,所以它们的体积比不一定为1∶1,错误。
考点:考查气体的物质的量与分子数、分子的构成微粒、体积等关系的知识。
本题难度:一般
3、选择题 下列说法中,正确的是
A.H2SO4的摩尔质量是98 g
B.常温常压下,18 g H2O含有10 mol e-
C.1 mol CO2的体积是22.4 L
D.0.1 mol/L Na2SO4溶液中,Na+的物质的量浓度为0.1 mol/L
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列表示不正确的是
A.1mol H2
B.1molFe
C.1mol小米
D.1mol NH3
参考答案:C
本题解析:略
本题难度:简单
5、选择题 0.2 mol锌和足量的稀盐酸反应,在标准状态下生成氢气的体积是?
A.4.48 L
B.2.24 L
C.1.12 L
D.0.2 L
参考答案:A
本题解析:Zn+2HCl=ZnCl2+H2↑ 当有 0.2 mol锌完全反应时,会生成0.2mol氢气,标况下为4.48L,故选A
本题难度:简单