时间:2025-06-25 22:12:48
1、填空题 (1)下列物质都能与Na反应放出H2: ①C2H5OH ②CH3COOH溶液 ③NaOH溶液,产生H2的速率由大到小的次序是?(填序号)
(2)某气态烃1体积只能与1体积氯气发生加成反应生成氯代烷,此氯代烷1mol可与4mol氯气生
完全的取代反应,则该烃的结构简式为?
(3)常温常压下CH4和C2H6混合后平均组成为C1.5H5,则二者的体积比为?。若平均组成为C1.2H4.4
则二者的体积比为?。
参考答案:(1)②>③>①? (2) CH2=CH2? (3)? 1:1? CH4和C2H6的体积比为4:1
本题解析:(1)乙醇中的羟基氢,能和钠反应生成氢气,醋酸中的氢离子能和金属钠反应放氢气,氢氧化钠溶液中的水电离出的氢离子可以和金属钠反应产生氢气,三者的氢的活泼性顺序是②>①>③,所以产生H2速率顺序是②>①>③;(2)根据题目中该烃加成反应所需氯气的量判断该烃分子中只含有一个双键,又根据氯代烷1mol可与4mol氯气发生完全的取代反应,判断该加成产物分子中只含有4个氢原子,所以该烃的结构简式为CH2=CH2;(3)常温常压下CH4和C2H6混合后平均组成为C1.5H5,设CH4和C2H6的体积分别为a和b,故a+2b/(a+b)=1.5,所以a=b,故二者的体积比为1:1 ,若平均组成为C1.2H4.4,设CH4和C2H6的体积分别为a和b,故a+2b/(a+b)=1.2,所以a=4b,故CH4和C2H6的体积比为4:1。
点评:本题综合考查了有机物的反应,烃的结构的判断,有机物计算,这些考点是高考考查的重点,本题难度不大。
本题难度:一般
2、选择题 某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1,由此可得出的结论是( )
A.该有机物分子中C、H、O原子个数比为1∶2∶3
B.分子中碳、氢原子个数比为2∶1
C.有机物中必定含氧
D.无法判断有机物中是否含有氧元素
参考答案:D
本题解析:n(H2O)∶n(CO2)=1∶1,n(H)∶n(C)=2∶1,无法确定是否含氧原子。
本题难度:一般
3、实验题 阿司匹林的有效成分是乙酰水杨酸(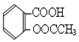 )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是?。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式?。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是?。判断该过程结束的方法是?。
② 滤液缓慢加入浓盐酸中,看到的现象是?。
③ 检验最终产品中是否含有水杨酸的化学方法是?。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
?。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为?。
参考答案:26.(12分)
(1)水浴加热(1分);(2)?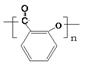 ?(2分)
?(2分)
(3)①使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离(1分);没有CO2产生(1分)。②有浑浊产生(1分)。③取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸。(2分)  (4)①
(4)①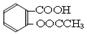 +3NaOH
+3NaOH CH3COONa+2H2O+?(2分)
CH3COONa+2H2O+?(2分)
②0.180 (aV1-bV2) /3m(2分)
本题解析:(1)温度不超过100℃,合成过程中最合适的加热方法是水浴加热。(2)制备过程中,水杨酸会发生自身缩聚反应,生成 。(3)粗产品提纯:① 分批用少量饱和NaHCO3溶解粗产品,目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离。判断该过程结束的方法是没有CO2产生。② 滤液缓慢加入浓盐酸中,看到的现象是有浑浊产生。③ 检验最终产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸。(4)① 乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
。(3)粗产品提纯:① 分批用少量饱和NaHCO3溶解粗产品,目的是使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离。判断该过程结束的方法是没有CO2产生。② 滤液缓慢加入浓盐酸中,看到的现象是有浑浊产生。③ 检验最终产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸。(4)① 乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式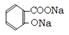 ?
?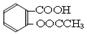 +3NaOH
+3NaOH CH3COONa+2H2O+ ?。② 根据反应方程式:得关系式:
CH3COONa+2H2O+ ?。② 根据反应方程式:得关系式: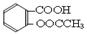 ―3NaOH;根据滴定方法:我们得到乙酰水杨酸质量,
―3NaOH;根据滴定方法:我们得到乙酰水杨酸质量,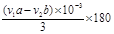 g,阿司匹林药片中乙酰水杨酸质量分数的表达式为
g,阿司匹林药片中乙酰水杨酸质量分数的表达式为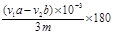 。
。
本题难度:一般
4、选择题 将0.4mol丁烷完全燃烧后生成的气体全部缓慢通人1L 2mol/LNaOH溶液中,生Na2CO3和NaHCO3的物质的量之比为?
A.3:2
B.2:3
C.2:1
D.1:3
参考答案:D
本题解析:据碳原子个数守恒可知,0.4摩尔丁烷可以生成1.6摩尔的二氧化碳。1L 2mol/LnaOH的物质的量为2摩尔。而二氧化碳与氢氧化钠反应生成碳酸钠,二氧化碳过量,因此应以氢氧化钠的量为基准进行计算。列出反应方程式可知,消耗的氢氧化钠与二氧化碳的量之比为2;1,因此会生成1摩尔的碳酸钠,同时还剩下0.6摩尔的二氧化碳。而剩余的0.6摩尔二氧化碳可以与0.6摩尔的碳酸钠继续反应生成1.2摩尔的碳酸氢钠,因此还剩余的碳酸钠就为1减去0.6等于0.4摩尔。所以碳酸钠与碳酸氢钠的物质的量之比就为1;3的关系,所以答案选D
本题难度:一般
5、填空题 (10分)下图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题。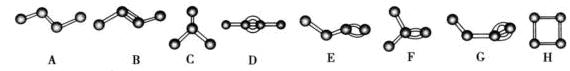
(1)属于烯烃类的有?(填编号);
(2)写出化合物B的结构简式?,H的分子式__________;
(3)指出上图有机化合物中官能团的名称?;
(4)A和C的关系是?;
(5)D与G的关系是?;
(6)有机物种类繁多的原因有?、?(至少答两种原因)
参考答案:(1)B、E、F;(2)CH3CH=CHCH3;C4H8;(3)碳碳双键、碳碳三键;(4)同分异构体;
(5)同分异构体;(6)碳原子链接方式多样;同分异构体(其他合理答案即可)
本题解析:(1)烯烃是分子中含有碳碳双键的不饱和链烃,在给出的物质中属于烯烃类的有B、E、F;(2)化合物B的结构简式是CH3CH=CHCH3;H的分子式是C4H8;(3)在上图有机化合物中官能团的名称是碳碳双键、碳碳三键;(4)A和C的分子式相同,结构不同,所以它们的关系是同分异构体;(5)D与G的分子式相同,结构不同,所以它们的关系是同分异构体;(6)有机物种类繁多是因为碳原子链接方式多样,存在同分异构体。
本题难度:一般