时间:2025-06-25 22:10:25
1、选择题 二甲醚是一种清洁燃料,以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)  CH3OCH3(g) +H2O(g) ?△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g) +H2O(g) ?△H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
A.上述反应△H>0
B.图中P1<P2<P3
C.若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆)
D.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
参考答案:C
本题解析:A、从图像看,反应温度越高,CO的转化率越小,说明正反应为放热反应,错误;B、该反应为体积减小的反应,压强越大,平衡正向移动,CO的转化率大,在图中作一等温线可知,P1对应的转化率大,则P1的压强大,错误;C、在P3和316℃时,CO的转化率为50%,设起始时,n(H2)=2a,n(CO)=a,平衡时,n(H2)=a,n(CH3OCH3)=0.25a,若n(H2)= n(CH3OCH3),则产物的量变多,故平衡需逆向移动,即逆反应速率大于正反应,正确;D、题中图表示的是n(H2)/n(CO)=2,若n(H2)/n(CO)=3,即H2的量增多,所以CO的转化率比原平衡时大,错误。
本题难度:一般
2、选择题 273K时,反应N2(g)+3H2(g)═2NH3(g)?生成2molNH3(g)时放出92.2kJ的热量.在该温度下,向一固定容积的密闭容器内通入1mol?N2和3mol?H2,达到平衡时,放出热量为Q1;向另一容积相同的密闭容器中通入0.5mol?N2和1.5mol?H2,达到平衡时放出热量为Q2.则下列判断不正确的是( )
A.同时进行时,用N2表示的反应速率:情况1>情况2
B.平衡时,情况1:Q1=92.2kJ
C.达到平衡时,混合气体的密度:情况1>情况2
D.平衡时,情况2:Q2<46.1kJ
参考答案:A、向一固定容积的密闭容器内通入1molN2和3molH2比向另一容积相同的密闭容器中通入0.5molN2和1.5molH2的浓度和压强均大,所以用N2表示的反应速率:情况1>情况2,故A正确;
B、向一固定容积的密闭容器内通入1molN2和3molH2,达到平衡时,生成氨气的量不足2mol,所以放出热量为Q1<92.2KJ,故B错误;
C、混合气体的密度ρ=mV,两情况下体积一样,所以充入的气体质量越多,密度越大,即情况1>情况2,故C正确;
D、另一容积相同的密闭容器中通入0.5mol N2和1.5mol H2,达到平衡时放出热量原则上讲应该是12×92.2kJ,但是情况2的压强比情况1的小了,平衡还会向逆向移动,放出的热量还会减小,即Q2<46.1kJ,故D正确.
故选B.
本题解析:
本题难度:一般
3、填空题 (10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
 |  |  |  |
 |  |  |  |
参考答案:(1)A+2B 2C(2分)
2C(2分)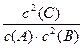 (1分)
(1分)
0.05mol·L-1·min-1(2分)
(2)加压(2分)
(3)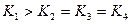 (2分)
(2分) (1分)
(1分)
本题解析:略
本题难度:一般
4、选择题 一定条件下,二氧化氮和四氧化二氮之间存在平衡:2NO2(g) N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是
N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果误差最小的是
[? ]
A.130℃ 3.03×105 Pa
B.25℃ 1.01×105 Pa
C.130℃ 5.05×104 Pa
D.0℃ 5.05×104 Pa
参考答案:C
本题解析:
本题难度:一般
5、选择题 可逆反应mA(g)+nB(s) rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是
rC(g)+qD(g)在反应过程中,其他条件不变,D的体积百分 含量和温度T 或压强P关系如图所示,下列叙述中正确的是
A.温度降低,化学平衡向正反应方向移动
B.使用催化剂,D的物质的量分数增加
C.化学方程式系数m+n = r+q
D.物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动
参考答案:A
本题解析:A.由左图知,温度T2为先到达平衡,故T2>T1,升高温度,升高温度,D%减小,则平衡向逆反应移动,A正确;B.使用催化剂,缩短到达平衡时间,平衡不移动,D%的不变,B错误;C、由右图可知,压强为P2先到达平衡,故P2>P1,增大压强,D%不变,则平衡不移动,反应中B为固体,故m=r+q,C错误;D.B为固体,物质B的颗粒越小,接触面积越大,反应越快,但对平衡移动没有影响,D错误.
考点:考查化学平衡的移动,化学平衡的影响因素,化学评横的图像等知识。
本题难度:一般