时间:2021-06-11 07:06:29
1、填空题 CO是常见的化学物质,有关其性质和应用的研究如下。
(1)有同学认为CO可以被酸性高锰酸钾溶液氧化为CO2,请你设计实验验证该同学的猜想是否正确。请在下列流程图方框内填上所需药品的名称或化学式,从而补齐你的设计,方框不够可以补,也可以不填满。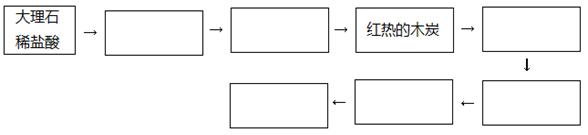
(2)CO和铁粉在一定条件下可以合成五羰基合铁[Fe(CO)5],该物质可用作无铅汽油的防爆剂,是一种浅黄色液体,熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。五羰基合铁的制备原理如下:
Fe(s)+5CO(g) Fe(CO)5(g)
Fe(CO)5(g)
①下列说法正确的是 。
A.利用上述反应原理可制备高纯铁
B.制备Fe(CO)5应在隔绝空气的条件下进行
C.反应Fe(s)+5CO(g) Fe(CO)5(g)的平衡常数表达式为
Fe(CO)5(g)的平衡常数表达式为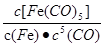
D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存
②五羰基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为: .
③今将一定量的Fe(CO)5的苯溶液,用紫外线照射片刻。取照射后的溶液完全燃烧,得到30.58gCO2、
5.4gH2O及1.6g红棕色粉末。红棕色粉末的化学式为 ,照射后的溶液中Fe(CO)5和Fe2 (CO)9的物质的量之比为 .
参考答案:(1)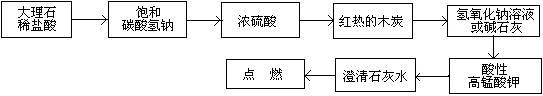
(2)①ABD ②Fe(CO)5+4NaOH=Na2Fe(CO)4+Na2CO3+2H2O ③Fe2O3; 2∶1
本题解析:大理石和盐酸发生反应产生二氧化碳气体。由于盐酸有挥发性,产生的二氧化碳气体中含有HCl气体和水蒸气,要先用饱和的碳酸氢钠溶液来除去HCl杂质,然后再用浓硫酸来干燥。将得到纯净的二氧化碳气体。通过灼热的木炭,二者反应氧化还原反应产生CO。用氢氧化钠溶液或碱石灰除去未反应的过量的CO2气体,将CO通入到酸性高锰酸钾溶液中,若CO可以被酸性高锰酸钾溶液氧化为CO2,会看到酸性高锰酸钾溶液的紫色褪色。用澄清的石灰水来检验并除去气体CO2,最后点燃未完全反应的CO气体,防止污染大气。(2)①A.该反应是可逆反应,利用该反应可以使固态的铁与CO反应产生液态的五羰基合铁[Fe(CO)5],使固态铁粉中的杂质过滤除去。正确。B.由于[Fe(CO)5],熔点—20.5℃,沸点103℃,光照时生成Fe2(CO)9,60℃发生自燃。所以反应要在在隔绝空气的条件下进行,以防止[Fe(CO)5]、CO及Fe的氧化和燃烧。正确。C.在该实验状态下Fe是固态,所以反应达到化学平衡时的平衡常数是K="C" [Fe(CO)5]/C5(CO). 错误。D.由于[Fe(CO)5]的熔点—20.5℃,沸点103℃,易溶于苯等有机溶剂,不溶于水,密度比水大,为1.46~1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃。因此Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。正确。选项为:ABD。②五羰基合铁能与氢氧化钠溶液反应的化学方程式为:Fe(CO)5+4NaOH=Na2Fe(CO)4+Na2CO3+2H2O。③根据质量守恒定律可知该红棕色粉末是Fe2O3,2[Fe(CO)5]= Fe2(CO)9+CO。n(Fe2O3)=1.6g÷160g/mol="0.01mol," n(Fe)="0.02mol." n(C)= 30.58g÷44g/mol=0.695mol.n(H2O)= 5.4g÷18g/mol=0.3mol,n(H)=0.6mol.因为在苯C6H6中碳原子核氢原子个数比为1:1,所以含铁化合物中含有的碳元素的物质的量为0.695mol-0.6mol=0.095mol。假设[Fe(CO)5]、Fe2(CO)9的物质的量分别为:X、Y,则X+2Y=0.02; 5X +9Y=0.095。联立求解。解得X=0.01;Y=0.005.所以X:Y=2:1.
考点:考查常见的化学物质CO的性质和应用的知识。
本题难度:困难
2、选择题 气体体积的大小,跟下列因素几乎无关的是 ( )
A.分子个数
B.分子直径
C.压强
D.温度
参考答案:B
本题解析:
试题解析: 影响物质体积的因素有微粒数目、分子本身大小以及分子间的距离等因素.温度、压强决定气体分子间距,对于气体来说,气体分子间的距离远大于分子本身的大小,分子本身可以忽略不计.
考点: 阿伏加德罗定律及推论
本题难度:一般
3、选择题 以NA表示阿伏加德罗常数,下列说法中正确的是
A.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
B. 0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L臭氧中含NA个氧原子
参考答案:B
本题解析:许多氢氧化铁分子构成氢氧化铁胶粒,1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒少于NA个,A错误;一个OH-含10个电子,B正确;D2O摩尔质量为20g/mol,一个D2O含10个中子,1.8g重水中中子数为0.9NA,C错误;标准状况下,11.2LO3物质的量为0.5mol,原子数为1.5mol,D错误。A
点评:胶粒由许多分子构成。
本题难度:一般
4、选择题 下列有关气体的叙述中,错误的是(? )
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为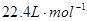
C.当分子数目相同时,气体体积的大小主要决定于气体分子之间的距离
D.一定温度和压强下,气体分子的物质的量决定了它们的体积
参考答案:A
本题解析:体积与温度和压强有关,当温度压强不同时,体积不同的气体分子数也可以相同,A错误。其他选项都正确。答案选A。
点评:气体的体积受温度和压强影响,不标明温度和压强时,不能指明气体的体积。
本题难度:简单
5、计算题 取10.6g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3的物质的量
(2)所得Na2CO3溶液的物质的量浓度
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
参考答案:16、(1)0.1mol (2)1mol/L (3)30
本题解析:(1)根据n=m/M=10.6/106=0.1mol;
(2)根据C=n/V=0.1/0.1=1mol/L
(3)设加水的体积为V, 1 mol/L×20=0.4mol/L×(20+V)解得V=30mL
考点:考查物质的量浓度的计算。
本题难度:一般