时间:2021-02-18 06:19:50
1、选择题 下述实验操作没有错误的是(?)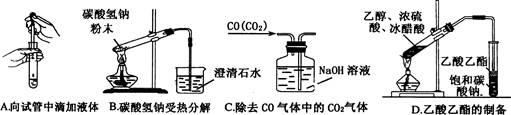
2、选择题 下列有关实验的叙述正确的是
A.分液时的分液漏斗的下端与过滤时漏斗的下端均要贴紧烧杯内壁,其原因相同
B.配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒
C.浓硫酸和浓氢氧化钠溶液溅到皮肤上,均应马上用大量的水冲洗,以防腐蚀皮肤
D.不用其它试剂,只用胶头滴管和试管即可鉴别出NaHCO3、Ba(OH)2、稀H2SO4三种溶液
3、选择题 下列实验操作正确的是
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②检查容量瓶是否漏水的方法是:往容量瓶中加水,塞好瓶塞,将容量瓶倒过来,若不漏水,将瓶塞旋转180°,再倒过来,看是否漏水
③配置氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口附近
⑧滴定管装液前,应该检查是否漏水
A.①④
B.②④⑤
C.①③
D.②③④⑥⑦⑧
4、选择题 下列装置或操作能达到实验目的的是(?)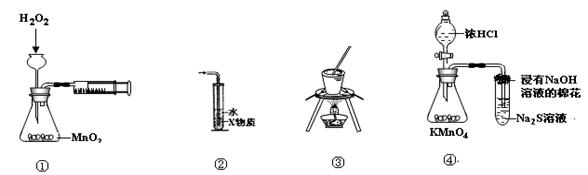
A.装置①可用于测定H2O2分解的反应速率
B.装置②中X为苯,可用于吸收氨气或氯化氢
C.装置③可用于实验室从食盐水中提取氯化钠
D.装置④可用于证明氧化性:KMnO4>Cl2>S
5、实验题 (18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。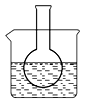
A.溶液显浅红色是因为Na2SO3水解呈酸性
B.水解反应为放热反应
C.水解反应为吸热反应
D.升高温度,Na2SO3水解程度增大
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O = 2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1)用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2)取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3)由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。