时间:2020-07-28 04:03:54
1、简答题 标况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准碳酸钠溶液滴定这种盐酸时,碳酸钠溶液应装在______式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从______色变成______色.
(2)现配制三种浓度的标准碳酸钠溶液,你认为最合适的是下列第______种.
①2.500mol/L?②0.25mol/L?③0.025mol/L
(3)若采用上述合适的标准碳酸钠溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待测盐酸体积(mL) | 滴入碳酸钠溶液体积(mL) 1 20.00 18.80 2 20.00 16.95 3 20.00 17.05 |
参考答案:(1)碳酸钠溶液呈碱性,用碱式滴定管盛装碳酸钠溶液;滴定终点时,溶液颜色由红色变为橙色且半分钟内不变色;故答案为:碱式;红色;橙色;
(2)HCl的大致浓度为122.4mol/L=0.045mol/L,标准碳酸钠溶液应选0.025mol/L,故选:③;
(3)(3)舍去第一组数据,碳酸钠溶液的平均体积为16.95+17.052,
?2HCl~Na2CO3
? 2? 1
?C(HCl)×20.00mL?0.025mol/L×16.95+17.052
? C(HCl)=2×C(Na2CO3)20.00×(16.95+17.05)2mol×L-1
故答案为:C(HCl)=2×C(Na2CO3)20.00×(16.95+17.05)2mol×L-1;
(4)盛装Na2CO3溶液的滴定管在滴定前未用标准液润洗,标准液的浓度降低,造成V(标准液)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知c(待测)偏高;滴定完毕后读数时俯视,造成V(标准液)偏小,根据c(待测)=c(标准)×V(标准)V(待测)可知c(待测)偏小,故答案为:偏高;偏低.
本题解析:
本题难度:一般
2、选择题 向20mL?NaOH溶液中逐滴加入0.1mol/L醋酸溶液,滴定曲线如图所示.下列判断正确的是( )
A.在M点,两者恰好反应完全
B.滴定前,酸中c(H+)?等于碱中c(OH-)
C.NaOH溶液的物质的量浓度为0.1?mol/L
D.在N点,c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)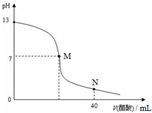
参考答案:C
本题解析:
本题难度:简单
3、选择题 某研究小组采用往一定体积的食醋中滴入已知浓度的NaOH溶液的方法测定食醋中醋酸的浓度.下列说法正确的是
A.滴定时,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
B.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
C.碱式滴定管若滴定前平视读数、滴定后俯视读数,则测定结果偏高.
D.酸式滴定管用水洗净后未用食醋润洗,则测得的食醋浓度偏高
参考答案:A
本题解析:
本题难度:困难
4、选择题 在100毫升某一元弱酸(Ka=10-3~10-7)的溶液中,以0. 50mol/L氢氧化钠溶液滴定后得滴定曲线如图所 示,下列叙述正确的是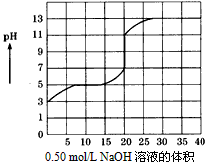
[? ]
A.该弱酸在滴定前的浓度是0. 15mol/L
B.该弱酸的电离常数(Ka)是10-5
C.在滴定过程,为求滴定终点,最合适的指示剂是酚酞
D.在滴定过程,为求滴定终点,最合适的指示剂是甲基橙
参考答案:BC
本题解析:
本题难度:一般
5、选择题 如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列正确的是(? )
A.盐酸的物质的量浓度为1?mol/L
B.酚酞不能作本实验的指示剂
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.P点时反应恰好完全,溶液呈中性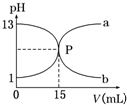
参考答案:D
本题解析:
本题难度:简单