时间:2019-07-04 00:52:18
1、填空题 根据所学知识完成下列空白。
Ⅰ.(1)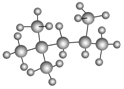 的名称(系统命名法)是 。
的名称(系统命名法)是 。
(2)(CH3)3CCH2CH(CH2CH3)CH(CH3)2的名称(系统命名法)是 。
(3)2,3-二甲基-4-乙基已烷 的结构简式______________________________。
Ⅱ.某盐的化学式为XmYn(m≠n),在水中能完全电离:XmYn=mXn++nYm-。将一定量的盐溶于足量水时:
(1)若测得溶液的pH为9,则该盐与水反应的离子方程式可能为: (用X或Y表示)。
(2)若X、Y为同周期的短周期元素,XmYn溶于水时,有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为:_________________________(用元素符号表示)。
2、选择题 下列有关物质的性质与应用的对应关系正确的是
A.碳酸钠溶液显碱性,用热的碳酸钠溶液可去除金属表面的油污
B.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
C.铝的熔点很高,可用于制作耐高温材料
D.浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体
3、选择题 NH4Cl溶液中,下列叙述正确的是( )
A.c(NH4+)>c(Cl—) >c(OH— ) >c( H+ )
B.c(Cl—)>c(NH4+)>c( H+ )>c(OH— )
C.c(NH4+) + c( NH3) = c(Cl—) + c(OH— )
D.c(NH4+) + c( NH3 · H2O) + c( NH3 )= c(Cl—)
4、填空题 (14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
5、选择题 下列有水参加的化学反应中,不属于水解反应的是( ? )
A.NH3+H2O?NH4++OH-
B.HCO3-+H2O?H2CO3+OH-
C.Al3++3H2O?Al(OH)3+3H+
D.NH4++2H2O?NH3?H2O+H3O+