时间:2019-06-28 21:27:20
1、选择题 实现反应:Cu+2H+=Cu2++H2↑,可以通过以下措施
A.将Cu投入稀硫酸中
B.让Cu在潮湿的环境发生电化学腐蚀
C.将Cu投入浓硫酸中并加热
D.用Cu作电极、稀硫酸作电解质溶液电解
参考答案:D
本题解析:A、将Cu投入稀硫酸中,铜和稀硫酸不反应,A错误;B、让Cu在潮湿的环境发生电化学腐蚀,发生的应该是吸氧腐蚀,B错误;C、将Cu投入浓硫酸中并加热生成SO2,C错误;D、用Cu作电极、稀硫酸作电解质溶液电解,铜是阳极失去电子,阴极氢离子发生生成氢气,D正确,答案选D。
考点:考查电化学原理的应用
本题难度:一般
2、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)N的电极反应式为 :
乙池的总化学方程式是 ,
加入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为200mL,则乙池中溶液的H+的浓度为 。
参考答案:(1)4OH--4e-=O2↑+2H2O(1分);
4AgNO3+2H2O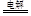 4Ag+4HNO3+2O2↑(2分);
4Ag+4HNO3+2O2↑(2分);
CH4-8e-+10OH-=CO32-+7H2O(2分)
(2)0.224(2分);0.2mol/L(2分)
本题解析:(1)甲池是以氢氧化钾溶液为电解液的甲烷燃料电池,通入甲烷的一极为原电池的负极,电极反应式为:CH4-8e-+10OH-=CO32-+7H2O,通入氧气的一极为原电池的正极,电极反应式为:O2 + 2H2O + 4e-=4OH-;乙池为电解池,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,N连接原电池的正极,为电解池的阳极,应为石墨材料,N为阳极,电极反应式是4OH--4e-=O2↑+2H2O,M为阴极,电极反应式为Ag++e-=Ag,电解的总反应为:4AgNO3+2H2O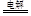 4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
4Ag+4HNO3+2O2↑;(2)n(Ag)=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,甲池中通入氧气的一极为正极,电极反应式为:O2 + 2H2O + 4e- = 4OH-,则消耗n(O2)=0.01mol,
V(O2)=0.224L;根据反应4AgNO3+2H2O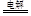 4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
4Ag+4HNO3+2O2↑知,n(H+)=n(HNO3)=0.04mol,又溶液的体积为200mL,则c(H+)=0.2mol/L。
考点:考查原电池原理、燃料电池及电解原理的应用。
本题难度:困难
3、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是(? )
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是
参考答案:C
本题解析:利用Fe3+的水解,除去CuSO4溶液中Fe3+方法是向其中加入黑色的CuO,与Fe3+水解产生的H+反应,促进Fe3+水解,使Fe3+转化为Fe(OH)3沉淀而除去,A错误;电解时,石墨作阳极,电极反应式:
4OH--4e-=2H2O+O2↑,C正确;
铜作阴极,电极反应式为:2Cu2++4e-=2Cu,B错误;
据两极上转移电子的量相等可知: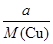 ×2=
×2=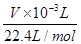 ×4,
×4,
解得:M(Cu)=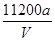 。
。
本题难度:一般
4、简答题 (15分)海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式?。
(2)图甲中流出的b是?溶液。
(3)石棉隔膜的作用是?。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH_?g。?
Ⅲ.下图是工业上生产镁的流程。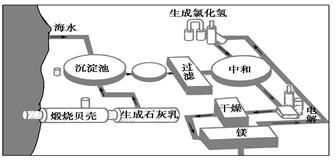
(1)写出下列反应的化学方程式:
①沉淀池:?;?②电解:?;
(2)整个生产流程中循环使用的物质是?。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项:?。
参考答案:Ⅰ.(1)2Cl--2e-=Cl2 ↑?(2)NaOH和NaCl?(3)阻止气体通过?
Ⅱ.(1)NaOH溶液?Na+?(2)80
Ⅲ.(1)①MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
?
 Mg+Cl2↑(2)氯气 (3)为了防止氯化镁水解,要在氯化氢气体的氛围中加热
Mg+Cl2↑(2)氯气 (3)为了防止氯化镁水解,要在氯化氢气体的氛围中加热本题解析:Ⅰ.(1)电解饱和NaCl溶液的阳极的反应式是2Cl--2e-=Cl2 ↑;(2)在阴极由于放电能力H+>Na+,所以阴极的电极反应式是:2H++2e-=H2↑.由于破坏了附近的水的电离平衡,使得阴极附近OH-浓度增大,所以图甲中流出的b是NaOH及未电离的NaCl的混合溶液。(3)石棉隔膜的作用是阻止气体通过,防止Cl2与阴极反应反应产物H2、NaOH发生反应。Ⅱ.(1)离子交换膜电解槽中⑥是NaOH溶液;⑦是Na+。(2)n(e-)=(1.929×105 C÷1.602×10-19C)÷6.02×1023=2.0mol。n(NaOH)=2.0mol;m(NaOH)=2.0mol×40g/mol=80g。Ⅲ.(1)由工业上生产镁的流程图可知:①沉淀池的化学反应方程式是MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;②在电解池中的化学反应方程式是MgCl2(熔融)  Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。
Mg+Cl2↑。(2)整个生产流程中循环使用的物质是氯气。(3)MgCl2是强酸弱碱盐,在加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的过程中,MgCl2会发生水解反应产生HCl和Mg(OH)2, HCl挥发逸出,最终得到的是Mg(OH)2。所以在加热的过程中要防止其水解。为了防止氯化镁水解,要在氯化氢气体的氛围中加热。最后蒸干得到的就是无水MgCl2。
本题难度:一般
5、选择题 用惰性电极电解下列溶液一段时间后,加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是
A.CuSO4(Cu(OH)2)
B.NaOH(NaOH)
C.NaCl(H2O)
D.CuCl2(CuCl2)
参考答案:D
本题解析:电解硫酸铜从溶液中出来的是铜单质和氧气,所以应该加入氧化铜。电解氢氧化钠生成的是氢气和氧气,所以应该加入水。电解氯化钠从溶液中出来的是氢气和氯气,应该加入氯化氢。电解氯化铜,生成物是铜和氯气,应该加入氯化铜。答案选D。
本题难度:一般