时间:2019-06-28 20:07:51
1、简答题 某研究性学习小组认为SiO2、SO2和CO2都是酸性氧化物,化学性质应具有一定的相似性,他们以课本知识“Mg在点燃的条件下可与CO2反应”为基础,设计了如图所示装置进行Mg和SO2反应的实验.据此请回答:
(1)若用下列物质中的两种相互混合反应制取SO2,则这两种物质最好是______(填代号).
①10%的H2SO4溶液
②50%的H2SO4溶液
③Na2SO3固体
④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式______.装置C中NaOH溶液的作用是______.
(3)你认为该装置是否有不足之处?如果有,请说明之.答:______.
(4)有同学认为,B管中的生成物中含有MgS,请你设计实验方案加以证明.答:______.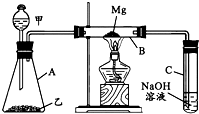
参考答案:Ⅰ(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水),
故选②③;
(2)高中已学的淡黄色的固体药品有:S、Na2O2、AgBr,具有臭鸡蛋气味的气体是硫化氢,能和盐酸反应生成氯化氢的淡黄色的固体药品是硫.
根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫,但单质硫能与镁反应生成硫化镁;反应方程式为:2Mg+SO2△.2MgO+S,Mg+S△.MgS.装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境;
故答案为:2Mg+SO2△.2MgO+S,Mg+S△.MgS;吸收多余的SO2,防止污染环境;
(3)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管.C装置未与大气相通;在镁下方未垫一不锈钢片,镁能与玻璃管反应;没有防倒吸装置,
故答案为:有,在A和B之间未连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,镁能与玻璃管反应;没有防倒吸装置;
(4)检验MgS,可加入稀硫酸,发生:MgS+H2SO4=MgSO4+H2S↑,H2S具有臭鸡蛋气味,
故答案为:可加入稀硫酸,发生:MgS+H2SO4=MgSO4+H2S↑,H2S具有臭鸡蛋气味.
本题解析:
本题难度:一般
2、选择题 下列实验中颜色变化正确的是(?)
A.鸡蛋清中加入浓硝酸出现黄色沉淀
B.淀粉溶液中加入KI溶液变蓝色
C.葡萄糖溶液与新制Cu(OH)2浊液混合加热出现砖红色沉淀
D.湿润的PH试纸遇氨气变红色
参考答案:AC
本题解析:鸡蛋清中加入浓硝酸出现黄色沉淀,因为鸡蛋清是含有苯环的蛋白质,含有苯环的蛋白质加入浓硝酸会出现黄色沉淀。A选项正确。淀粉溶液中加入碘单质变蓝色,而KI溶液没有此现象。B选项错误。葡萄糖溶液与新制Cu(OH)2浊液混合加热出现砖红色沉淀。C选项正确。湿润的PH试纸遇氨气呈碱性应变蓝色。D选项错误。
点评:了解教材所提到的典型的实验的操作及现象的描述,是正确解答这类题的基础,所以在学业水平复习时更要回归课本。
本题难度:简单
3、选择题 下列各组中的实验步骤及现象,能达到相应实验目的的是
| ? | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 | 试样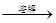 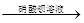 白色沉淀 白色沉淀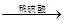 沉淀不溶解 沉淀不溶解 |
| B | 制取氯气并探究氯气是否具有漂白性 | MnO2和稀盐酸 气体 气体 褪色 褪色 |
| C | 证明酸性条件H2O2氧化性比I2强 | 碘化钠溶液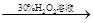 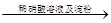 溶液变蓝色 溶液变蓝色 |
| D | 探究浓度对于化学平衡的影响 | FeCl3和KSCN混合溶液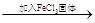 红色变深 红色变深 |
参考答案:D
本题解析:A、由于在酸性条件下,NO3-具有强氧化性,能把SO32-氧化生成SO42-,进而生成硫酸钡白色沉淀,所以检验亚硫酸钠是否变质时应该用氯化钡,不能用硝酸钡,A不正确;B、二氧化锰只能氧化浓盐酸制备氯气,与稀盐酸是不反应的,B不正确;C、由于稀硝酸具有强氧化性,能把碘化钾氧化生成单质碘,从而时淀粉溶液显蓝色,因此不能用稀硝酸,应该用盐酸或稀硫酸,C不正确;D、加入氯化铁固体,增大铁离子的浓度,红色加深,说明平衡向正反应方向移动,因此可以说明浓度对平衡状态的影响,D正确,答案选D。
本题难度:一般
4、简答题 某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验.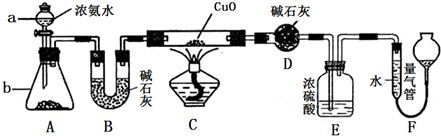
请回答下列问题:
(1)仪器a的名称为______;仪器b中可选择的试剂为______;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有______性,写出相应的化学方程式______;
(3)E装置中浓硫酸的作用是______;
(4)读取气体体积前,应对装置F进行的操作是:______若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将______.(填“偏大”、“偏小”或“不变”).
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O:______.
(6)此套实验装置还可用于测定氨气的分子组成.若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示).
参考答案:(1)装置中仪器a为分液漏斗;仪器b是利用分液漏斗中滴入的氨水使锥形瓶中的固体溶解放热促进一水合氨分解生成氨气,氢氧化钠固体、氧化钙固体、碱石灰固体,
故答案为:分液漏斗;固体氢氧化钠或氧化钙或碱石灰;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,说明氨气和氧化铜反应生成铜和氮气与水,氨气被氧化铜氧化表现还原性,结合原子守恒配平写出的化学方程式为3CuO+2NH3△.3Cu+3H2O+N2 ,故答案为:还原;3CuO+2NH3△.3Cu+3H2O+N2 ;
(3)依据流程分析,浓硫酸是吸收过量的氨气,阻止F中水蒸气进入D影响实验效果,故答案为:吸收未反应的氨气,阻止F中水蒸气进入D;
(4)读取气体体积前,应对装置F进行的操作是慢慢上下移动右边漏斗,使左右两管液面相平,保持压强平衡再读数;量气管中的液面低于水准管的液面,说明内部气压大于大气压,则量气管中气体的体积将偏小,故答案为:慢慢上下移动右边漏斗,使左右两管液面相平,偏小;
(5)根据已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+),得出检验该红色物质中是否含有Cu2O的方法:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有,
故答案为:取少许样品,加入稀H2SO4(或稀盐酸),若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有;
(6)若测得干燥管D增重mg为水物质的量=mg18g/mol,装置F测得气体的体积为nL(已折算成标准状况)为N2,物质的量=nL22.4L/mol,依据元素守恒得到氮原子和氢原子物质的量之比=nL22.4L/mol×2:mg18g/mol×2=9n11.2m,则氨分子中氮、氢的原子个数比为9n11.2m,故答案为:9n11.2m.
本题解析:
本题难度:一般
5、实验题 如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。 
(1)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(2)简述生成Fe(OH)2的操作过程__________。
(3)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为______________。
(4)下列各图示中_____能较长时间看到Fe(OH)2白色沉淀。 
参考答案:(1)打开
(2)关闭活塞a,使FeSO4溶液压入B中进行反应
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①②④
本题解析:
本题难度:一般