时间:2019-05-30 05:18:43
1、选择题 将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
A.有AgCl沉淀析出
B.无AgCl沉淀析出
C.无法确定有无AgCl沉淀析出
D.有沉淀但不是AgCl
2、填空题 重金属离子(Cu2+、Hg2+、Cd2+、Pb2+等)是常见的有毒污染物,水体、土壤及生物一旦受到重金属离子的污染就很难去除,重金属污染给生态环境和人类自身造成严重危害.某公司以含重金属的废水为原水,处理废水工艺流程如图1所示: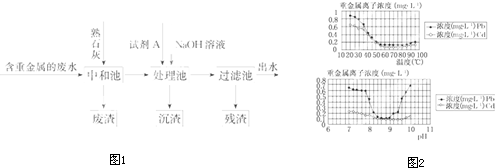
已知下列物质的Ksp:
| Cu(OH)2 | CuS | FeS | PbS | HgS | CdS 2.2×10-20 8.5×10-45 6.3×10-18 3.4×10-28 4×10-53 8×10-29 |
3、简答题 (1)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5?mol?L-1.若忽略水的电离及H2CO3的第二级电离,请计算可逆反应H2CO3
HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)
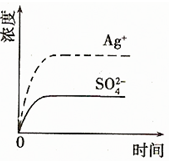
(2)已知Ag2SO4的Ksp?为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol?L-1).若t1时刻在上述体系中加入100mL?0.020mol?L-1?Na2SO4?溶液,请通过计算说明该溶液中是否有沉淀析出?(写出计算过程,忽略体积变化)
下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是______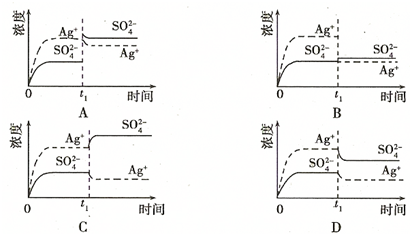
4、选择题 下列说法正确的是
A.难溶电解质的溶度积越小,溶解度越大
B.可以通过沉淀反应使杂质离子浓度为0
C.难溶电解质的溶解平衡是一种静态平衡
D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2
5、选择题 在含有浓度均为0.01mol?L-1的Cl-、Br-、I-离子的溶液中,缓慢加入AgNO3稀溶液,析出三种沉淀的先后顺序是(?)
A.AgCl、AgBr、AgI
B.AgI、AgBr、AgCl
C.AgBr、AgCl、AgI
D.三种沉淀同时析出